工业上常利用反应 3Cl2+8NH3 =6NH4Cl+N2 检查氯气管道是否漏气。回答下列问题:
(1)该反应中,氧化剂是 ,发生氧化反应的物质是 。
(2)该反应中氧化剂与还原剂的物质的量之比为 。
(3)若标准状况下有6.72L N2生成,则转移电子的物质的量为 mol。
亚铁盐不稳定,在空气中易被氧化,因此在存放FeSO4溶液时,常加入 ,其理由是 (用离子方程式表示)。
新制的氯水,呈浅黄绿色,说明氯水中含有 分子(填化学式);向新制氯水中,加入AgNO3溶液有白色沉淀产生,说明氯水中含 离子(填离子符号);向新制氯水中,放入一块有色布条,一段时间后取出,发现有色布条褪色,说明氯水具有 性。
实验室常用消石灰和NH4Cl固体混合加热制取氨气,回答下列问题:
(1)写出该反应的化学方程式 。
(2)要得到纯净干燥的氨气,可选用的干燥剂是 。
| A.浓硫酸 | B.碱石灰 | C.五氧化二磷 | D.固体NaOH |
(3)检验氨气常用的方法是 。
有下列四种物质:①SiO2 ②HF ③NaHCO3 ④Na2O2 按要求填空(填序号):
(1)常用来作为呼吸面具或潜水艇中供氧剂的是 。
(2)可以在玻璃上刻字、雕刻花纹的是 。
(3)可以作为食用碱,也是焙制糕点发酵粉的主要成份的是 。
(4)由它制成的光导纤维,抗干扰性能好,通信质量高,并且能防窃听,是当前信息社会必不可少的高技术材料,它是 。
材料是人类生存、科技发展的重要物质基础。请回答:
(1)玻璃、陶瓷、水泥中除了都含有氧元素外,还都含有 (填元素名称或元素符号)元素。
(2)新型镁合金被大量应用于制成笔记本电脑外壳、竞赛自行车框架等,原因是镁合金具有 等优异性能。
A.耐腐蚀 B.硬度大 C.密度小
(3)塑料、合成橡胶和 是常说的三大合成材料。
(4)具有 (填“热塑性”或“热固性”)的塑料饮料瓶通过分类、清洗、加热熔融,可重新成为制品。这样做的意义在于 (说出一点即可)。
水是一种宝贵的自然资源。改善水质,化学工作者大有作为。请回答:
(1)向源水中加入明矾做混凝剂,可以使水中的悬浮颗粒物沉降。这一过程发生了 (填“化学”或“物理”或“既有化学又有物理”)变化。
(2)氯气可用来消毒,这是基于Cl2 + H2O =" HClO" + ,产物中
(填化学式)具有强氧化性。
(3)硬水中Ca2+、Mg2+浓度较大,会给生产和生活带来许多不便,生活中可用 的方法降低它的硬度。
(4)每年3月22日是世界水日。下列有关说法或做法不符合这一主题的是
A.鼓励使用含磷洗衣粉,使水体富营养化
B.将造纸厂、化工厂建在水源地上游以节约成本
C.合理开发水资源,建立水资源节约设备
我国从1994年起在食盐中添加碘酸钾(KIO3)作为营养强化剂。请回答:
(1)成人如果长期缺碘,会引起的病症是 (填字母)。
A.佝偻病 B.甲状腺肿大 C.夜盲症
(2)在瘦肉、胡萝卜、海带中,富含碘元素的是 。
(3)依据化学方程式为:5KI+KIO3+6HCl = 6KCl+3I2 +3H2O可检验加碘盐中是否含有碘。此反应中的还原剂是 (填化学式),生成的含I2的溶液遇淀粉可变为 色。
家庭厨房是一个化学小世界,“柴米油盐”中包含着许多化学知识。
(1)人体需要的营养素主要有糖类、油脂、蛋白质、维生素、矿物质和 。从科学的角度讲,一日三餐应以富含 的食物为主食。
(2)绿色植物通过光合作用转化的食品叫绿色食品;海洋提供的食品叫蓝色食品;通过微生物发酵制得的食品叫白色食品。根据此分类,花生油属于__________食品。
(3)食物的选择要注意其酸碱性。蛋白质属于 (填“酸性”或“碱性”)食物。这 (填“是”或“不是”)因为这类食物在味觉上有酸味。
(4)请写出常用食品防腐剂的化学式或名称 (只写出一种)。
现有下列10种物质:
①NaHCO3;②NH4HCO3;③BaSO4;④HF;⑤C2H5OH;⑥Al;⑦食盐水;⑧CH3COOH; ⑨HCl; ⑩NaOH。
(1)其中属于非电解质的是_____________(填序号,下同),既能跟盐酸反应又能跟NaOH溶液反应的是_____________。
(2)NaHCO3溶液显 性(填“酸”、“碱”或“中”),原因是(结合离子方程式表示)
。
(3)常温时有四种溶液:Ⅰ.pH=4的CH3COOH溶液;Ⅱ.pH=4的HCl溶液;Ⅲ.pH=10的NaOH溶液;Ⅳ.pH=10的CH3COONa溶液。(已知常温时醋酸的电离常数为1.75×10-5)
下列有关叙述正确的是 。(忽略溶液混合时的体积变化)
| A.Ⅱ、Ⅲ溶液分别与10g铝粉充分反应,生成H2的量Ⅲ一定更多 |
| B.Ⅰ与Ⅱ等体积混合后,溶液中的c(CH3COO-)为原溶液浓度的1/2 |
| C.将Ⅰ和Ⅲ等体积混合后,溶液pH一定小于7 |
| D.四种溶液各10mL分别加水稀释至100mL后,溶液的pH:Ⅲ>Ⅳ>Ⅰ>Ⅱ |
(4)常温时某HCl溶液中由水电离出的C(H+)=1×10-amol/L,而相同pH的AlCl3溶液中由水电离出的C(H+)=1×10-bmol/L (已知a, b均为小于14的正整数),则a和b之间满足的关系为 , (用一个等式和一个不等式表示)。
I、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术处理尾气,化学方程式为2NO + 2CO 2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/mol·L-1 |
1.00×10-3 |
4.50× 10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
| c(CO)/mol·L-1 |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答(均不考虑温度变化对催化效率的影响):
(1)若上述反应的平衡常数K,随温度增高而减小,则反应的ΔH 0(填“>”、“<”或“=”)。
(2)前2s内的平均反应速度v (N2)= 。
(3)该温度下,反应的平衡常数K= 。
II、甲醇空气燃料电池(酸性电解质溶液)的工作原理如下图一所示。
(1)该电池正极的电极反应式为 。
(2)以上述电池为电源,构成图二电解池 ,其中X、Y为石墨,a为KCl溶液,写出电解总反应的离子方程式 。
(3)常温时,按“(2)”电解一段时间后,取25mL上述电解后的溶液,滴加0.2mol/L的醋酸溶液,滴加过程的pH变化如图三所示,则C点对应溶液中各离子浓度的大小关系为(忽略电解后溶液中的其他成分,只考虑其中的碱与加入的酸 ) 。
黑火药是中国古代四大发明之一,它的爆炸反应为:
2KNO3+3C+S 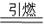 K2S+N2↑+3a 已配平
K2S+N2↑+3a 已配平
①画出氮原子的结构示意图 。
②生成物中除氮气与硫化钾外,还有一种物质A生成,则A的化学式为 。
③黑火药中位于元素周期表短周期的元素有 种;其中一种元素的氧化物可用于漂白纸浆、丝、草帽辫等并能用于杀菌、消毒,该元素在周期表中的位置是 ,写出该氧化物通入FeCl3溶液反应的离子方程式 。
④下列事实能说明黑火药中碳与硫两元素非金属性相对强弱的是 。
| A.同条件同浓度溶液的pH:H2CO3>H2SO4 | B.稳定性:H2SO4>H2CO3 |
| C.CS2中碳元素为+4价,硫元素为-2价 | D.溶解性:H2S>CH4 |
⑤已知常温时CuS的Ksp=1.3×10-36,向100 ml 2×10-18 mol/L 的K2S溶液中加入100 ml
2×10-18 mol/L的CuCl2溶液,试通过计算说明有无CuS沉淀生成(写出计算推理过程,忽略溶液混合时的体积变化)。 。
运用化学反应原理研究氢、氧、氯、碘等单质及其化合物的反应有重要意义
(1)已知:25℃时KSP(AgCl)=1.6×l0-10 KSP(AgI)=1.5×l0-16
海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在。在25℃下,向0.1L0.002mol·L-l的NaCl溶液中加入0.1L0.002mol·L-l硝酸银溶液,有白色沉淀生成,产生沉淀的原因是(通过计算回答) ,向反应后的浑浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是 (填序号)。
A.BaO2 + H2SO4= BaSO4 ↓ + H2O2
B.2NH4HSO4 (NH4)2S2O8 + H2↑
(NH4)2S2O8 + H2↑
(NH4)2S2O8 + 2H2O = 2NH4HSO4 + H2O2
C.CH3CHOHCH3 + O2→ CH3COCH3 + H2O2
D.乙基蒽醌法见下图
(3)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示。
注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg·L―1的条件下进行。图1中曲线a:H2O2;b:H2O2+Cu2+;c:H2O2+Fe2+;d:H2O2+Zn2+;e:H2O2+Mn2+;图2中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关)。
由上述信息可知,下列叙述错误的是 (填序号)。
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小
合成氨尿素工业生产过程中涉及到的物质转化过程如下图所示。
(1)天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为 。
(2)甲烷是一种清洁燃料,但不完全燃烧时热效率降低,同时产生有毒气体造成污染。
已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g)=2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率是完全燃烧时的_____倍(计算结果保留1位小数)。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的正极反应式是____ ____。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(4)运输氨时,不能使用铜及其合金制造的管道阀门。因为在潮湿的环境中,金属铜在有NH3存在时能被空气中的O2氧化,生成[Cu(NH3)4]2+,该反应的离子方程式为 。
已知甲和乙在溶液中的转化关系如图所示:
请回答下列问题:
(1)若甲是10电子的单核微粒,乙是两性氢氧化物,则微粒甲的结构示意图为 。
(2)若甲是10电子的阳离子,乙是碱性气体。1mol乙通入足量强酸溶液中与H+反应,反应过程中能量变化如下图:
写出乙的一种用途: ;
该反应的热化学方程式是___________________________。
(3)若甲是CrO42-(黄色)和Cr2O72-(橙色)的混合溶液,在该溶液中存在如下平衡:
CrO42-(黄色) + 2H+ Cr2O72-(橙色) + H2O
Cr2O72-(橙色) + H2O
若测得甲溶液的pH=1,该溶液显 色。
(4)若甲仅含有NO3-、SO42-和X三种离子,则X离子可能是 (填序号) 。
| A.Fe2+ | B.HCO3- | C.Ba2+ | D.Fe3+ |
(5)若甲是CO2,乙中HCO3-和CO32-的物质的量浓度相等,此时溶液的pH=10,
则HCO3-的电离平衡常数Ka= 。
试题篮
()