沐舒坦(结构简式为 ,不考虑立体异构)是临床上使用广泛的。下图所示的是多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的。下图所示的是多条合成路线中的一条(反应试剂和反应条件均未标出)

完成下列填空:
(1)写出反应试剂和反应条件。反应①反应⑤。
(2)写出反应类型。反应③反应⑥。
(3)写出结构简式。
。
(4)反应⑥中除加入反应试剂外,还需要加入
,其目的是为了中和。
防止。
(5)写出两种的能发生水解反应,且只含3种不同化学环境氢原子的同分异构体的结构简式。
(6) 反应②,反应③的顺序不能颠倒,其原因是。
 异构化可得到三元乙丙橡胶的第三单体
异构化可得到三元乙丙橡胶的第三单体 。
。 由A(C5H6)和B经Diels-Alder反应制得。Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是
由A(C5H6)和B经Diels-Alder反应制得。Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是
完成下列填空:
(1)Diels-Alder反应属于反应(填反应类型):A的结构简式为(2)写出与 互为同分异构体,且一溴代物只有两种的芳香烃的名称:
互为同分异构体,且一溴代物只有两种的芳香烃的名称:
写出生成这两种一溴代物所需要的反应试剂和反应条件。(3)B与Cl2的1,2-加成产物消去HCl得到2-氯代二烯烃,该二烯烃和丙烯酸(CH2=CHCOOH)聚合得到的聚合物可改进氯丁橡胶的耐寒性和加工性能,写出该聚合物的结构简式。(4)写出实验室由 的属于芳香烃的同分异构体的同系物制备
的属于芳香烃的同分异构体的同系物制备 的合成路线,(合成路线常用的表示方式为:
的合成路线,(合成路线常用的表示方式为: 目标产物)
目标产物)
元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素
基态原子的3p 轨道上有4个电子。元素
的原子最外层电子数是其内层的3倍。
(1)与
所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,离子的数目为。
②该化合物的化学式为。
(2)在的氢化物(
)分子中,
原子轨道的杂化类型是。
(3)的氢化物(
)在乙醇中的溶解度大于
,其原因是。
(4)与
可形成
①的空间构型为(用文字描述)。
②写出一种与互为等电子体的分子的化学式:。
(5)的氯化物与氨水反应可形成配合物
,1
该配合物中含有σ键的数目为。
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷()可由
、焦炭和
在一定条件下反应获得。相关热化学方程式如下:
则 =
。
(2)白磷中毒后可用溶液解毒,解毒原理可用下列化学方程式表示:
60能氧化白磷的物质的量是。
(3)磷的重要化合物、
和
可通过
与
溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与
的关系如图所示。

①为获得尽可能纯的,
应控制在;
=8时,溶液中主要含磷物种浓度大小关系为。
②溶液显碱性,若向溶液中加入足量的
溶液,溶液则显酸性,其原因是(用离子方程式表示)。
(4)磷的化合物三氯氧磷( )与季戊四醇(
)与季戊四醇(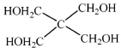 )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体,并释放出一种酸性气体。季戊四醇与
的核磁共振氢谱如下图所示。

①酸性气体是(填化学式)。
②的结构简式为
化合物A(分子式为)是一种有机化工原料,在空气中易被氧化。
A 的有关转化反应如下(部分反应条件略去):
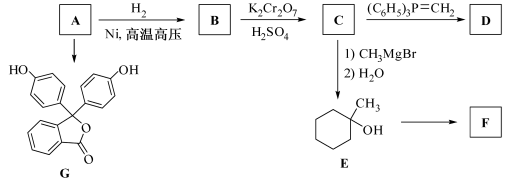
已知:①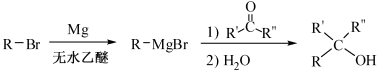
②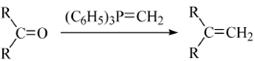
(表示烃基,
和
表示烃基或氢)
(1)写出 的结构简式:。
(2)是常用指示剂酚酞。写出
中含氧官能团的名称:和。
(3)某化合物是的同分异构体,且分子中只有两种不同化学环境的氢。写出该化合物的结构简式:
(任写一种)。
(4)和
互为同分异构体。写出反应
→
的化学方程式:。
(5)根据已有知识并结合相关信息,写出以和
为原料制备
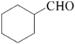 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种"金属"。这种"金属"可能是。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
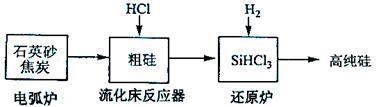
| 发生的主要反应 |
|
| 电弧炉 |
 |
| 流化床反应器 |
 |
| 还原炉 |
 |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为;碳化硅又称,其晶体结构与相似。
②在流化床反应的产物中,大约占85%,还有
、
、
等,有关物质的沸点数据如下表,提纯
的主要工艺操作依次是沉降、冷凝和。
| 物质 |
|||||||
| 沸点/℃ |
2355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
③极易水解,其完全水解的产物为。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是。
溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入,将其中的氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为
和
,其离子方程式为。
(2)溴与氯能以共价键结合形成。
分子中,显正电性。
与水发生反应的化学方程式为。
(3)分解的热化学方程式为:
在密闭容器中将过量于487
下加热分解,平衡时
为4.66×103
。
①如反应体系的体积不变,提高反应温度,则将会(填"增大"、"不变"或"减小")。
②如反应温度不变,将反应体系的体积增加一倍,则的变化范围为。
脱水偶联反应是一种新型的直接烷基化反应,例如:
(1)化合物Ⅰ的分子式为 ,1mol该物质完全燃烧最少需要消耗 molO2。
(2)化合物Ⅱ可使 溶液(限写一种)褪色;化合物Ⅲ(分子式为C10H11Cl)可与NaOH水溶液共热生成化合物Ⅱ,相应的化学方程式为______。
(3)化合物Ⅲ与NaOH乙醇溶液共热生成化合物Ⅳ,Ⅳ的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为为1:1:1:2,Ⅳ的结构简式为_______。
(4)由CH3COOCH2CH3可合成化合物Ⅰ,化合物Ⅴ是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物Ⅵ,Ⅴ的结构简式为______,Ⅵ的结构简式为______。
肉桂酸异戊酯G( )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:
已知以下信息:
① ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A的化学名称为 。
(2)B和C反应生成D的化学方程式为 。
(3)F中含有官能团的名称为 。
(4)E和F反应生成G的化学方程式为 ,反应类型为 。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为 (写结构简式)。
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。若其晶胞边长为540.0pm,则密度为 ,X与最近的Y之间的距离为
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
A、B、C、D、E、F、G七种元素,它们的原子序数依次增大,除G外均为前20号元素。A原子基态时p能级原子轨道上电子数等于次外能层电子数,C元素的原子基态时s能级与p能级上的电子数相等,C、D处于相同的能级,且D是同期中电负性最大的元素,E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575,F元素原子中4s能级有2个电子。G元素的离子形成的硫酸盐结晶水合物呈蓝色。
(1)B形成的单质中σ键和Π键的个数比为 ,上述元素形成的化合物中和B的单质是等电子体的是__________(填化学式)
(2)G元素的基态原子的电子排布式为 。
(3)常温下,E单质投入到B的最高价氧化物对应的水化物的浓溶液中的现象是 。
(4)D、F组成的晶体FD2结构如图Ⅰ所示,G形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3(硼酸)晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)。
图Ⅰ 图Ⅱ 图Ⅲ
①图Ⅰ所示的FD2晶体中与F离子最近且等距离的F离子数为 ,图Ⅲ中未标号的G原子形成晶体后周围最紧邻的G原子数为 ;
②图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是 (写元素符号),H3BO3晶体中B原子个数与极性键个数比为 ;
③三种晶体中熔点高低的顺序为 (填化学式),H3BO3晶体受热熔化时,克服的微粒之间的相互作用为 。
图一是煤化工产业链的一部分,试运用所学知识,回答下列问题:
图一
(1)图一中气体A的俗称是_______________
(2)合成氨工业是煤化工产业链中非常重要的一步。已知有一组数据:破坏1mol氮气中的化学键需要吸收946 kJ能量;破坏0.5mol氢气中的H-H键需要吸收218kJ的能量;形成氨分子中1 mol N-H键能够释放389kJ能量。图二表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值,填在下边的横线上。 
图二
① kJ ,② kJ
(3)煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇,该反应的化学方程式为:CO (g) + 2H2(g) CH3OH(g)
CH3OH(g)
①下列描述中能说明上述反应已达平衡的是_______;
A. 容器内气体的平均摩尔质量保持不变
B. 2v(H2)正 = v(CH3OH)逆
C. 容器中气体的压强保持不变
D. 单位时间内生成n molCO的同时生成2n mol H2
②在容积固定的恒温密闭容器中充入CO和H2发生上述反应,反应在第4 min时候达到其限度,此时容器中压强与反应前之比为3︰5,容器内物质的各种物质的量浓度如下表:
| 时间/浓度 |
c(CO)(mol/L) |
C(H2 )(mol/L) |
c(CH3OH)(mol/L) |
| 起始 |
0.200 |
0.300 |
0.000 |
| 第4 min |
a |
b |
c |
则b=__________________
(4)甲醇—空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理如下图所示,该燃料电池的电池反应式为2CH3OH (g) + 3O2(g) = 2CO2(g) + 4H2O(l),则负极的电极反应式为______________________,正极附近pH值_______________(填写“增大”、“减小”或者“不变”)
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应: CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量变化:
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)= ;
H2的转化率w(H2) = 。
②该反应的平衡常数表达式K= 。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:_____________。
已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:
(1)B的结构简式是
(2)A可能属于下列哪类物质___________
a.醇 b.卤代烃 c.酚 d.羧酸
(3)反应①是D与HCl按物质的量之比1︰1的加成反应,则D的分子式是___________。
反应②可表示为:G + NH3 → F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示):
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:  )
)
(4)甲的结构简式是 _________________。
由甲苯生成甲的反应类型是_________________。
(5)乙中有两种含氧官能团,反应③的化学方程式是
(6)丙中官能团的名称是 。
(7)普鲁卡因有两种水解产物丁和戊。
①戊与甲互为同分异构体,戊的结构简式是_____________________。
②戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是 。
③ D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键。则D与F在一定条件下反应生成丁的化学方程式是________________________________。
煤的“气化”是使煤变成清洁能源的有效途径之一,其主要反应为:C+H2O CO↑+H2↑。甲
CO↑+H2↑。甲
酸苯丙酯(F)是生产香料和药物的主要原料。下图是用煤为原料合成甲酸苯丙酯的路线图(部分反应条件和生成物已略去)其中D的分子式为C9H10O,且能发生银镜反应。

根据上述转化关系回答下列问题:
(1)写出A、D的结构简式:
A:________________________ D:__________________________
(2)D→E的反应类型为_____________,B中的官能团是_____________。
(3)写山检验B中的官能团的试剂及出现的现象。
试剂_____________,现象_______________________________________。
(4)写出C与E反应生成F的化学方程式_______________________________________。
(5) “合成气”( CO、H2)除作合成有机物的原料外,还有其它用途,如_____________(举两例)。
(6)F有多种同分异构体,写出满足下列条件的两种同分异构体的结构简式。
①属于酯类,且能发生银镜反应。 ②苯环上的一氯取代物只有两种结构。
③分子结构中只有两个甲基。
_______________________________________、_______________________________________
试题篮
()