捕碳技术(主要指捕获)在降低温室气体排放中具有重要的作用。
目前和
已经被用作工业捕碳剂,它们与
可发生如下可逆反应:
反应Ⅰ:2+
+

反应Ⅱ:+
+

反应Ⅲ:+
+
 2
2
请回答下列问题:
(1)与
、
之间的关系是:
。
(2)为研究温度对捕获
效率的影响,在某温度T1下,将一定量的
溶液置于密闭容器中,并充入一定量的
气体(用氮气作为稀释剂),在
时刻,测得容器中
气体的浓度。然后分别在温度为
、
、
、
下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得
气体浓度,得到趋势图(见图1)。则:
①
0(填>、=或<)。
②在~
及
~
二个温度区间,容器内
气体浓度呈现如图1所示的变化趋势,其原因是。
③反应Ⅲ在温度为时,溶液
随时间变化的趋势曲线如图2所示。当时间到达
时,将该反应体系温度上升到
,并维持该温度。请在图中画出
时刻后溶液的
变化总趋势曲线。()

(3)利用反应Ⅲ捕获,在
初始浓度和体积确定的情况下,提高
吸收量的措施有(写出2个)。
(4)下列物质中也可能作为捕获剂的是。
| A. |
|
B. |
|
| C. |
|
D. |
|
氢能源是一种重要的清洁能源。现有两种可产生
的化合物甲和乙。将6.00
甲加热至完全分解,只得到一种短周期元素的金属单质和6.72
(已折算成标准状况)。甲与水反应也能产生
,同时还产生一种白色沉淀物,该白色沉淀可溶于
溶液。化合物乙在催化剂存在下可分解得到
和另一种单质气体丙,丙在标准状态下的密度为1.25
。请回答下列问题:
(1)甲的化学式是;乙的电子式是。
(2)甲与水反应的化学方程式是。
(3)气体丙与金属镁反应的产物是(用化学式表示)。
(4)乙在加热条件下与反应可生成
和气体丙,写出该反应的化学方程式。
有人提出产物中可能还含有,请设计实验方案验证之。
(已知)
(5)甲与乙之间(填"可能"或"不可能)发生反应产生,判断理由是。
聚酰胺-66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成:

已知反应:
(1)能与银氨溶液反应的B的同分异构体的结构简式为,
(2)的结构简式为,①的反应类型为,
(3)为检验中的官能团,所用试剂包括NaOH水溶液及
(4)由和
生成H的反应方程式为
。
卤族元素包括等。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是。

(2)利用"卤化硼法"可合成含和
两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有
原子的个数为,该功能陶瓷的化学式为。

(3)和
中心原子的杂化方式分别为和。第一电离能介于
、
之间的第二周期元素有种。
(4)若与
通过
原子与
原子间的配位键结合形成配合物,则该配合物中提供孤对电子的原子是。
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式: CuO+ Al2O3 CuAlO2 + ↑。
CuAlO2 + ↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0mol•L—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、过滤、洗涤和干燥。
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)=IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq) HOI(aq) △H2
HOI(aq) △H2
③HOI(aq)+ I-(aq)+ H+(aq) I2(aq)+H2O(l) △H3
I2(aq)+H2O(l) △H3
总反应的化学方程式为______,其反应△H=______。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3-(aq),其平衡常数表达式为_______。
I3-(aq),其平衡常数表达式为_______。
(3)为探究Fe2+对氧化I-反应的影响(反应体系如图),某研究小组测定两组实验中I3-浓度和体系pH,结果见图和下表。
| 编号 |
反应物 |
反应前pH |
反应后pH |
| 第1组 |
O3+ I- |
5.2 |
11.0 |
| 第2组 |
O3+ I-+ Fe2+ |
5.2 |
4.1 |
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为 。由Fe3+生成A的过程能显著提高I-的转化率,原因是_______。
③第2组实验进行18s后,I3-下降。导致下降的直接原因有(双选)______。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图14,计算3~18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
脱水偶联反应是一种新型的直接烷基化反应,例如:
反应①:
(1)化合物I的分子式为_____,1mol该物质完全燃烧最少需要消耗_____molO2。
(2)化合物II可使____溶液(限写一种)褪色;化合物III(分子式为C10H11C1)可与NaOH水溶液共热生成化合物II,相应的化学方程式为______。
(3)化合物III与NaOH乙醇溶液共热生成化合物IV,IV的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为为1∶1∶1∶2,IV的结构简式为_______。
(4)由CH3COOCH2CH3可合成化合物I。化合物V是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物VI。V的结构简式为______,VI的结构简式为______。
(5)一定条件下, 与
与 也可以发生类似反应①的反应,有机产物的结构简式为_____。
也可以发生类似反应①的反应,有机产物的结构简式为_____。
已知:
为合成某种液晶材料的中间体,有人提出如下不同的合成途径
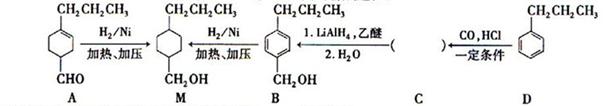
(1)常温下,下列物质能与发生反应的有(填序号)
a.苯 b. c.乙酸乙酯 d.
溶液
(2)中官能团的名称是,由
→
反应类型为。
(3)由催化加氢生成
的过程中,可能有中间生成物
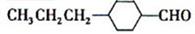 和(写结构简式)生成
和(写结构简式)生成
(4)检验B中是否含有C可选用的试剂是(任写一种名称)。
(5)物质也可由
与
水溶液共热生成,
的结构简式为。
(6)的一种同分异构体
具有如下特点:
a.分子中含- b.苯环上只有两种化学环境不同的氢原子
写出在一定条件下发生加聚反应的化学方程式。
(1)依据第2周期元素第一电离能的变化规律,参照下图元素的位置,用小黑点标出
三种元素的相对位置。

(2)可由
和
在
催化剂存在下反应直接得到:
①上述化学方程式中的5种物质所属的晶体类型有(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为。
(3)与一定量水形成
晶体
,
在一定条件下可转化为
:
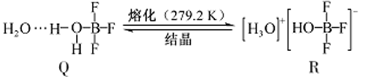
①晶体中各种微粒间的作用力不涉及(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②中阳离子的空间构型为,阴离子的中心原子轨道采用杂化。
(4)已知苯酚(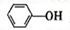 )具有弱酸性,其
)具有弱酸性,其=1.1 ×10-10;水杨酸第一级电离形成的离子
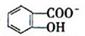 能形成分子内氢键。据此判断,相同温度下电离平衡常数
能形成分子内氢键。据此判断,相同温度下电离平衡常数(水杨酸
(苯酚)(填">"或"<"),其原因是。
利用化石燃料开采、加工过程产生的废气制取氢气,既廉价又环保。
(1)工业上可用组成为的无机材料纯化制取的氢气
①已知元素、
均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则
的原子结构示意图为
②常温下,不能与单质发生反应的是(填序号)
a.溶液 b.
c.浓硫酸 d.
e.
固体
(2)利用废气制取氢气来的方法有多种
①高温热分解法
已知:在恒温密闭容器中,控制不同温度进行
分解实验。以
起始浓度均为
测定
的转化率,结果见右图。图中a为
的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时
的转化率。据图计算985℃时
按上述反应分解的平衡常数
=_;说明温度的升高,曲线b向曲线a逼近的原因:

 ②电化学法
②电化学法
该法制氢过程的示意图如右。反应池中反应物的流向采用气、液逆流方式,其目的是;反应池中发生反应的化学方程式为。反应后的溶液进入电解池,电解总反应的离子方程式为_。
芳香化合物是一种基本化工原料,可以从煤和石油中得到。
是一种重要的有机化工中间体。
和
的转化关系如下所示:

回答下列问题:
(1)的化学名称是;
(2)由生成
的反应类型是。在该反应的副产物中,与
互为同分异构体的化合物的结构简式为;
(3)写出所有可能的结构简式;
(4)(邻苯二甲酸二乙酯)是一种增塑剂。请用A、不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成
。用化学方程式表示合成路线;
(5)的化学名称是,
经中间体
可合成一种聚酯类高分子化合物
,由
合成
的反应类型为,该反应的化学方程式为。(提示
 )
)
(6)芳香化合物是
的同分异构体,
分子中含有醛基、酯基和醚基三种含氧官能团,写出
所有可能的结构简式。
铝是一种应用广泛的金属,工业上用和冰晶石(
)混合熔融电解制得。
①铝土矿的主要成分是和
等。从铝土矿中提炼
的流程如下:

②以萤石()和纯碱为原料制备冰晶石的流程如下:

回答下列问题:
(1)写出反应1的化学方程式;
(2)滤液Ⅰ中加入生成的沉淀是,反应2的离子方程式为;
(3)可作为建筑材料,化合物
是,写出由
制备冰晶石的化学方程式;
(4)电解制铝的化学方程式是,以石墨为电极,阳极产生的混合气体的成分是。
是汽车尾气中的主要污染物之一。
(1) 能形成酸雨,写出
转化为
的化学方程式:.
(2)汽车发动机工作时会引发和
反应,其能量变化示意图如下:

①写出该反应的热化学方程式:.
②随温度升高,该反应化学平衡常数的变化趋势是。
(3)在汽车尾气系统中装置催化转化器,可有效降低的排放。
①当尾气中空气不足时,在催化转化器中被还原成
排出。写出
被
还原的化学方程式:.
② 当尾气中空气过量时,催化转化器中的金属氧化物吸收生成盐。其吸收能力顺序如下:
.原因是.
(4)通过传感器可监测
的含量,其工作原理示意图如下:

①电极上发生的是反应(填"氧化"或"还原")。
②写出电极的电极反应式: .
可降解聚合物的合成路线如下

已知:

(1)的含氧官能团名称是。
(2)羧酸的电离方程是。
(3)的化学方程式是。
(4)化合物苯环上的一氯代物有2种,
的结构简式是。
(5)中反应①和②的反应类型分别是。
(6)的结构简式是。
(7)聚合物的结构简式是。
有机物是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去):

(1)的结构简式是;
中含有的官能团名称是
(2)由和
合成
的化学方程式是
(3)同时满足下列条件的苯的同分异构体的结构简式是
①含有3个双键; ②核磁共振氢谱只显示1个吸收峰; ③不存在甲基。
(4)乙烯在实验室可由(填有机物名称)通过(填反应堆类型)制备。
(5)下列说法正确的是
a. 属于饱和烃 b.
与乙醛的分子式相同
c.不能与盐酸反应 d.
可以发生酯化反应
试题篮
()