有一包NaHCO3和KHCO3的混合物样品。某研究性学习小组对其进行如下探究。实验装置如图所示。将一定质量的混合物样品加入锥形瓶中,用针筒a分次注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒壁之间的摩擦)
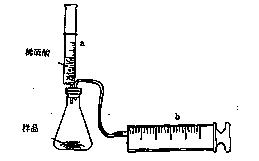 |
(1)为了较准确地测量反应生成的CO2体积,必须保证整个装置的气密性良好。如果往锥形瓶中注入稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2 mL,则反应中生成的CO2气体体积为 mL。
(2)某学生通过实验,测得如下数据(所用稀硫酸的物质的量浓度相矧),下列分析推理错误的是 。
| |
50mL稀硫酸 |
50mL稀硫酸 |
50mL稀硫酸 |
| m(混合物) |
9.2g |
15.7g |
27.6g |
| V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
①稀硫酸的物质的量浓度为1.5mol/L
②15.7 g混合物恰好与稀硫酸完全反应
③加入混合物9.2 g时稀硫酸未反应完
④计算出样品中NaHC03和KHC03物质的量之比为1:1
(3)某同学设计了另一种方案,其操作流程如下: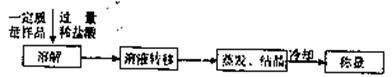
在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHC03和KHC03物质的量之比 (选填“偏人”、“偏小”或“不变”)。
金属钛素有“太空金属”、“海洋金属”、“未来金属”等美誉,我国有丰富的钛矿资源。
(1)钛冶炼的旧法是用金属钠热还原四氯化钛。
请回答下列问题:
①试推测,在金属系列中,钛属于 (填“较活泼”或“较不活泼”)的金属。金属钛耐腐蚀可能原因是 。
②TiC14 工业上是用过量焦炭、氯气与TiO2在高温下反应制得的,该反应的化学方程式为 。
(2)已知化合态的钛:有+4价和+3价,其中+3价极易被氧化。有关氢氧化物开始沉淀的pH如表l
表l 有关氢氧化物开始沉淀的pH
| 氢氧化物 |
Ti(OH)4 |
Ti(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
| pH |
0.5 |
3.0 |
1.5 |
7.6 |
某地钛铁矿的主要成分为FeTiO3,含有少量杂质Al2O3、SiO2,提纯TiO2并得到副产品绿矾(FeSO4·7H2O)的工艺流程如图l所示。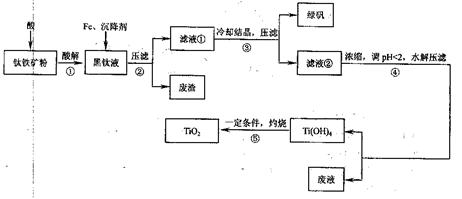
图1 工艺流程图
黑钛液中生成的主要阳离子有TiO2+、Fe2+,写出反应①主要的化学方程式: ;加入Fe的目的是 ;步骤④生成Ti(OH)4的离子方程式: 。
(3)钛冶炼的新法是电解法,图2是一种电解制钛的工艺(OS法)示意图。CaC12/CaO共熔体为质,在阴极,被还原的Ca进一步还原TiO2得到钛,写出阴极制得钛的有关反应方程式 。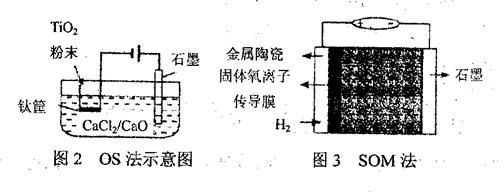
(4)我国科学最新研发的技术——固体透氧膜提取金属钛(SOM)工艺(见图3):将钛氧化物(钛全看作Ti4+)矿熔于MCl—MF融盐体系(M为Na、K、Ca等),以石墨为阴极,阳极为覆盖氧渗透膜的多孔金属陶瓷涂层。固体透氧膜把阳极和熔融电解质隔开,只有氧离子可以通过,电解过程中阴极通入H2,则阳极电极反应式为 。
高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于饮用水和生活用水的处理。从环境保护的角度看,制备高铁酸盐较好的方法为电化学法。
(1)电化学法制备高铁酸钠采用铁片作阳极,NaOH溶液作为电解质溶液,其电流效率可达到40%。写出阳极产生高铁酸钠的电极反应方程式: 。
(2)铁丝网电极是更理想的阳极材料,相同条件下,可将电流效率提高至70%以上,原因是 。研究亦发现,铁电极在某一电压范围内会产生氧气使阳极表面生成Fe2O3膜而“钝化”。写出产生O2的电极反应方程式: 。
(3)FeO42—易与水4h生成絮状氢氧化铁,也会影响高铁酸盐的产率。若以铁丝网为阳极,在中间环节(对应图中4h后)过滤掉氢氧化铁,反应过程中FeO42—浓度以及电流效率随时间的变化如图1中实线所示(图中曲线是每隔1h测得的数据)。图中虚线部分对应于没有过滤氢氧化铁而连续电解的情况。下列判断正确的是 (填编号)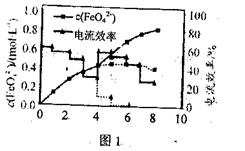
①过滤:掉氢氧化铁有利于获得较高浓度的高铁酸盐溶液
②过滤掉氢氧化铁对电流效率影响不大
③实验表明不过滤掉氢氧化铁,6h后电流效率几乎为0
(4)在相同的pH条件下,经过相同的反应时间,高铁酸盐的产率与温度关系如图2。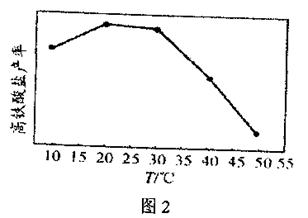
随温度升高,高铁酸盐产率先增大后减小的原因是 。
(5)人们还对用铁的氧化物作电极制备高铁酸盐进行了研究,例如以磁铁矿多孔电极制备高铁酸盐,该研究方向的价值有 (至少答一点)。
[化学选修──有机化学基础]
根据图示回答下列问题: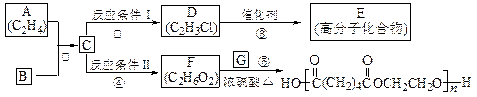
(1)写出A、E、G的结构简式:A_____________,E_______________,G______________;
(2)反应②的化学方程式(包括反应条件)是_________________________,
(3)反应④化学方程式(包括反应条件)是______________________ ______________;
(4)写出①、⑤的反应类型:①________________、⑤__________________。
为研究铁质材料与热浓硫酸的反应,某小组进行了以下探究活动:
[探究一]
(1)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中是否含有Fe2+,应选择加入的试剂为____ (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。据此推知气体Y 中SO2的体积分数为____ 。(相对原子质量:O—16 S—32 Ba—137)
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。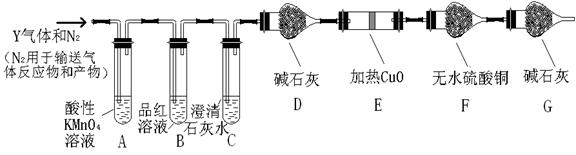
(2)写出产生CO2的化学方程式___ _。
(3)装置A中试剂的作用是____ 。
(4)简述确认气体Y中含有CO2的实验现象 。
(5)如果气体Y中含有H2,预计实验现象应是 。
下图中A~J均代表无机物或其水溶液,其中A是一种红棕色粉末,B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。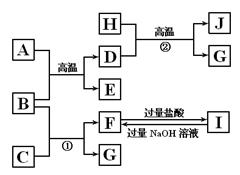
根据图示回答问题:
(1)写出下列物质的化学式:A ,E ,I ;
(2)反应①的化学方程式是 ;
反应②的化学方程式是 ;
(3)J与盐酸反应的离子方程式是 ;
反应后的溶液与D反应的化学方程式是 。
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+离子,不经处理排放危害极大。某工厂技术人员设计了创新方案,使有害离子的浓度降低到排放标准,同时得到了纯度较高的镍粉。
废液经分析组成如下: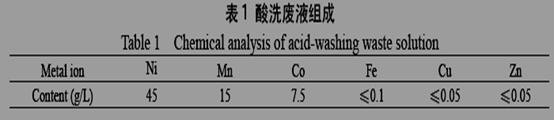
在强酸性的废液中加入NaOH调节pH到2,在搅拌下加入饱和Na2CO3溶液和NaClO除去Mn2+、Co2+,并控制pH不超过3.5(Na2CO3需缓慢加入,防止产生大量CO2而冒槽),过滤后电解含Ni2+的过滤液,以镍铬钛不锈钢片为阴极,以铅片为阳极,电解后在阴极得到镍粉。回答下列问题
⑴ 调节强酸性废液至pH=2,可否直接用饱和Na2CO3溶液?分析你的原因
⑵ 写出除去废液中Mn2+、Co2+的反应方程式
⑶ 搅拌过程中Ni不被沉淀下来,实际操作中是如何实现?
⑷ 电解过程中电流效率与pH的关系如下图,试分析如下图所示变化的原因.并选择电解的最佳pH值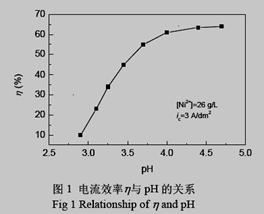
化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能。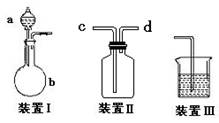
(1)甲认为装置Ⅰ可作为实验室快速制氧气的发生器,则装置Ⅰ的a仪器中可加入 , b仪器中加入 ;或a仪器中可加入 , b仪器中加入 。装置Ⅱ从 管口进气可作为O2的收集装置。
(2)乙认为利用装置II,可收集NO,试简述操作方法:
。
(3)丙认为利用装置Ⅰ和装置Ⅲ,可验证Cl2的氧化性比Br2强,进行此项实验时在装置Ⅰ中的a仪器中加入___________试剂,b仪器中加入________ 试剂,装置Ⅲ中应加入适量的 试剂,根据装置Ⅲ中观察到的 实验现象即可得出Cl2的氧化性比Br2强的结论。
试题篮
()