某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
(1)烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
(2)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。
待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的 (填仪器序号“a”或“b”)起到了确保硫酸体积保持不变的作用。
(3)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行___ _、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反
应的硫酸的最低浓度是 。
(4)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因: ,
。
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~10nm之间).下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题.
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接 , 接 , 接h;
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 ,试写出制纳米级碳酸钙的离子方程式 ;
(3)在浓CaCl2溶液和NH3用量正确的情况下,CO2不足或过量都会导致纳米级碳酸钙产量下降,若CO2过量溶液中大量存在的离子有(不考虑弱电解质的电离和盐类水解产生的少量离子)_____________________________,
(4)取反应后去除CaCO3的溶液分别做以下实验,下列实验判断合理的是:_________.
| A.滴加少量Na2CO3溶液,若有沉淀说明CO2一定不足. |
| B.滴加少量盐酸,若有气泡,CO2一定过量. |
| C.测量溶液pH,若小于7,CO2一定过量 |
| D.滴加少量BaCl2溶液,若无沉淀,CO2一定没有过量. |
(5)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级 .
某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-。为了鉴别这些离子,分别取少量溶液进行以下实验:
①所得溶液呈碱性;
②加HCl后,生成无色无味的气体。该气体能使饱和石灰水变浑浊。
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色。
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
⑤加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验 ,写出每一实验鉴定离子的结论与理由。
,写出每一实验鉴定离子的结论与理由。
实验①________________________________________。
实验②_______________________________________。
实验③____ ____________________________________。
____________________________________。
实验④________________________________________。
实验⑤________________________________________。
(2)上述5个实验不能确定是否的离子是___________________。
(12分)某化学研究性学习小组探讨Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验。
⑴提出猜想:
甲同学认为发生氧化还原反应,其反应的离子方程式为 ;
乙同 学认为发生双水解反应,其反应方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;
学认为发生双水解反应,其反应方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;
⑵实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质, 应选用的试剂是 。
应选用的试剂是 。
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
⑶得出结论:
①根据丙同学的实验得出的结论是: ;
②实验③中溶液变成血红色的离子方程式为 。
⑷拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是 。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32- (填“大”或“小”)外,还有
某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
| 实验 |
药品 |
制取气体 |
量气管中的液体 |
| ① |
Cu、稀HNO3 |
|
H2O |
| ② |
NaOH固体、浓氨水 |
NH3 |
|
| ③ |
Na2CO3固体、稀H2SO4 |
CO2 |
|
| ④ |
镁铝合金、NaOH溶液(足量) |
H2 |
H2O |

请回答下列问题:
(1)简述如何检查该装置的气密性: 。
(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度。你认为是否可行?请简述原因。 。
( 3)实验②中剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有
3)实验②中剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有 

、(4)实验③中,量气管中的液体最好是 。
| A.H2O | B.CCl4 | C.饱和Na2CO3溶液 | D.饱和NaHCO3溶液 |
(5)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,② ,③视线与凹液面最低处相平。
(6)实验④获得以下数据(所有气体体积均已换算成标准状况)
| 编号 |
镁铝合金质量 |
量气管第一次读数 |
量气管第二次读数 |
| ①[ |
1.0g |
10.0mL |
346.3mL |
| ② |
1.0g |
10.0mL |
335.0mL |
| ③ |
1.0g |
10.0mL |
345.7mL |
根据上述合理数据计算镁铝合金中铝的质量分数 。
学习小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验: 取适量牙膏样品,加水搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是____
____________________________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是_____
_____________________________________________________________________。
Ⅱ.牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有______
(4)C中反应生成BaCO3的化学方程式是__________________________
(5)下列各项措施中,不能提高测定准确度的是_________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体; b.滴加盐酸不宜过快;
c.在A—B之间增添盛有浓硫酸的洗气装置
d.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为_________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是
_________________________________________________________________________。
用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③溶解 ④转移、洗涤 ⑤定容、摇匀。完成下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是__________________________ ______。
______。
(3)第⑤步实验的操作是________________________________。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中________________________________
B.容量瓶用蒸馏洗涤后残留有少量的水_______C.所用过的烧杯、玻璃棒未洗涤_________
D.定容时俯视刻度线________________E.用量筒量取浓硫酸时俯视观察凹液面
Fe2O3和Cu2O都是常用的红色颜料。某红色粉末可能含有Fe2O3和Cu2O,某化学实验小组通过实验来探究该红色粉末的成分。已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
(1)提出假设 假设1:红色粉末只含Fe2O3;
假设2:_______________________________;
假设3:红色粉末是Fe2O3和Cu2O的混合物。
(2)初步探究: 取少量红色粉末于小烧杯中,放入足量稀硫酸,充分搅拌后粉末全部溶解(温馨提示:Cu+2Fe3+=Cu2++2Fe2+)。上述三个假设中,可能成立的是___________ 。
(3)进一步探究:完成后续实验方案的设计,填写下表中实验步骤、预期实验现象和结论(可不填满,也可补充)。
限选实验试剂:3 mol·L—1 H2SO4、3 mol·L—1 NaOH、0.01 mol·L—1 KMnO4、20% KSCN、3%H2O2、淀粉-KI溶液。
| 实验步骤 |
预期现象和结论 |
| |
|
(11分)化学兴趣小组设计以下实验方案,测定已部分变质的某小苏打样品中Na2CO3的质量分数。
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
________________________________________________________________________。
(2)实验中需加热至恒重的目的是:
________________________________________________________________________。
(3)实验中确定加热至恒重的方法是:
________________________________________________________________________。
(4)若加热过程中坩埚内有晶体迸溅出来,则测得的结果________(填“偏大”、“偏小”或“不变”)。
[方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-===BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为______________。
(2)实验中判断沉淀是否完全的方法是
________________________________________________________________________________________________________________________________________。
(3)实验中洗涤沉淀的操作是
________________________________________________________________________。
(4)实验中判断沉淀是否洗涤干净的方法是
_______________________________________________________________________________________________________________________________________________。
[方案三]
按如图所示装置进行实验: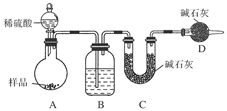
(1)B装置内所盛试剂是________;D装置的作用是______________;分液漏斗中________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9 g样品,实验后测得C装置增重8.8 g,则样品中Na2CO3的质量分数为________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:____________________。
(8分)(2011·西宁模拟)甲醛是世界卫生组织(WHO)确认的致癌物质和致畸物质之一。我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组打算利用酸性KMnO4溶液测定新装修房屋内的空气中甲醛的含量,请你参与并协助他们完成相关的学习任务。
测定原理:
酸性KMnO4为强氧化剂,可氧化甲醛和草酸,其反应方程式如下所示:
4MnO4-+5HCHO+12H+===4Mn2++5CO2↑+11H2O
2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
测定装置:
部分装置如下图所示: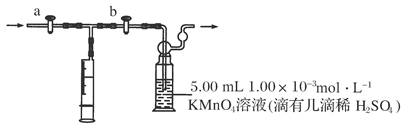
测定步骤:
(1)用______________量取5.00 mL 1.00×10-3mol·L-1KMnO4溶液,注入洗气瓶中,并滴入几滴稀H2SO4,加水20 mL稀释,备用。
(2)将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用。
(3)打开a,关闭b,用注射器抽取100 mL新装修房屋内的空气。关闭________,打开________(填“a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再重复4次。
(4)将洗气瓶中的溶液转移到锥形瓶中(包括洗涤液),再用草酸标准溶液进行滴定,记录滴定所消耗的草酸标准溶液的体积。
(5)再重复实验2次(每次所取的高锰酸钾溶液的体积均为5.00 mL)。3次实验所消耗的草酸标准溶液的体积平均值为12.38 mL。
交流讨论:
(1)计算该新装修房屋内的空气中甲醛的浓度为________mg·m-3,该新装修房屋内的甲醛________(填“是”或“否”)超标;
(2)某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设称量或量取、溶液配制及滴定实验均无错误)提出合理假设:______________、______________(至少答出两种可能性);
(3)实验结束后,该小组成员在相互交流的过程中一致认为:
①实验原理可以简化
实验中可不用草酸标准溶液滴定,可多次直接抽取新装修房屋内的空气,再推送到洗气瓶中,直至_________________________________________________________;
②实验装置应加以改进
可将插入酸性KMnO4溶液中的导管下端改成具有多孔的球泡(如图所示),有利于提高实验的准确度,其理由是___________________________________________________。
(8分)(2011·苏州模拟)已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO3-六种离子。向试管A的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
(1)试管A的溶液中所含上述离子共有________种。
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管为________(填“A”或“B”)。
(3)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是________(填化学式)。
(4)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为
________________________________________________________________________、______________________________________________________________________。
(5)若试管A和试管B中共有四种物质按等物质的量溶解于试管中,再将A和B中的溶液混合过滤,所得滤液中各种离子的物质的量之比为________。
(6)若向由试管A的溶液中阳离子组成的碳酸氢盐溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为________________________________________________________。
(8分)实验室常用的几种气体发生装置如图A、B、C所示:
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是________;
检查C装置气密性是否良好的操作方法是________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
下图是某学生设计收集气体的几种装置,其中不可行的是________。
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2
(8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验 编号 |
HA物质的量 浓度(mol· L-1) |
NaOH物质的 量浓度(mol· L-1) |
混合溶液的 pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,
若a________7(填“>”、“<”或“=”),则HA为强酸;
若a________7(填“>”、“<”或“=”),则HA为弱酸。
(2)在乙组中混合溶液中离子浓度c(A-)与c(Na+)的大小关系是( )
| A.前者大 | B.后者大 |
| C.二者相等 | D.无法判断 |
(3)从丙组实验结果分析,HA是________酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是___________________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
(8分)Ⅰ.(1)饱和氯化铵溶液显酸性,原因是
________________________________________________________________________
________________________________________________________________________;
向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解;其合理的解释(用相关离子方程式表示)为
________________________________________________________________________
________________________________________________________________________。
(2)向Mg(OH)2悬浊液中加入适量CH3COONH4溶液,
Mg(OH)2能否完全溶解________(填“能”或“否”),理由是
________________________________________________________________________
________________________________________________________________________。
Ⅱ.硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4===H++HSO4-,HSO4-===H++SO42-。
请回答下列有关问题:
(1)Na2SO4溶液呈________(填“弱酸性”“中性”或“弱碱性”),其理由是________________________________________________________________________
(用离子方程式表示);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度关系正确的是________(填写编号);
| A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4) |
| B.c(OH-)=c(HSO4-)+c(H+) |
| C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| D.c(Na+)=2c(SO42-)+2c(HSO4-) |
(4)写出NaHSO4溶液中溶质电离常数(Ka)的表达式________________;
(5)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO2-4)=0.029 mol·L-1,则0.10 mol·L-1的H2SO4溶液中c(SO42-)________0.029 mol·L-1(填“<”“>”或“=”),其理由是________________________________________________________________________;
(6)如果25℃时,0.10 mol·L-1H2SO4溶液的pH=
-lg 0.11,则0.10 mol·L-1的H2SO4溶液中c(SO42-)=________mol·L-1。
(8分)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用________(填编号字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视______________;在铁架台上垫一张白纸,其目的是________________________________________________________________________
________________________________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol·L-1,烧碱样品的纯度是________。
| 滴定次数 |
待测溶液 体积(mL) |
标准酸体积 |
|
| 滴定前的刻度 (mL) |
滴定后的刻度 (mL) |
||
| 第一次 |
10.00 |
0.40 |
20.50 |
| 第二次 |
10.00 |
4.10 |
24.00 |
(5)下列实验操作会对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
试题篮
()