氮的氧化物( )是大气污染物之一,工业上在一定温度和催化剂条件下用 将 还原生 成 , 某同学在实验室中对 与 反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的_ , 反应的化学方程式为_ 。
②预收集一瓶干燥的氨气,选择上图中的装置, 其连接顺序为: 发生装置→ (按气流方向, 用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的 充入注射器 中, 硬质玻璃管 中加入少量催化剂, 充入 (两端用夹 子 夹好)。在一定温度下按图示装置进行实验。

| 操作步骤 |
实验现象 |
解释原因 |
| 打开 , 推动注射器活塞, 使 X中的气体缓慢通入 Y 管中 |
(1)Y 管中 |
(2反应的化学方程式 |
| 将注射器活塞退回原处并固 定, 待装置恢复到室温 |
Y 管中有少量水珠 |
生成的气态水凝集 |
| 打开 |
|
|
氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景。通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图所示):

Ⅰ.将浓 、 、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入 粉末。塞好瓶口。
Ⅱ.转至油浴中, 搅拌1小时。缓慢滴加一定量的蒸馏水。升温至 并保持1小时。
Ⅲ.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加 至悬浊液由紫色变为土黄色。
Ⅳ.离心分离,稀盐酸洗涤沉淀。
Ⅴ.蒸馏水洗涤沉淀。
Ⅵ.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
(1)装置图中,仪器a、c的名称分别是 、 ,仪器b的进水口是 (填字母)。
(2)步骤Ⅰ中,需分批缓慢加入 粉末并使用冰水浴,原因是 。
(3)步骤Ⅱ中的加热方式采用油浴,不使用热水浴,原因是 。
(4)步骤Ⅲ中, 的作用是 (以离子方程式表示)。
(5)步骤Ⅳ中,洗涤是否完成,可通过检测洗出液中是否存在 来判断。检测的方法是 。
(6)步骤Ⅴ可用 试纸检测来判断 是否洗净,其理由是 。
某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO 4•7H 2O ):
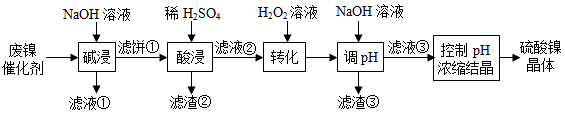
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |
Ni 2+ |
Al 3+ |
Fe 3+ |
Fe 2+ |
| 开始沉淀时(c=0.01 mol•L ﹣ 1)的pH 沉淀完全时(c=1.0×10 ﹣ 5mol•L ﹣ 1)的pH |
7.2 8.7 |
3.7 4.7 |
2.2 3.2 |
7.5 9.0 |
回答下列问题:
(1)"碱浸"中NaOH的两个作用分别是 。为回收金属,用稀硫酸将"滤液①"调为中性,生成沉淀。写出该反应的离子方程式 。
(2)"滤液②"中含有的金属离子是 。
(3)"转化"中可替代H 2O 2的物质是 。若工艺流程改为先"调pH"后"转化",即  ,"滤液③"中可能含有的杂质离子为 。
,"滤液③"中可能含有的杂质离子为 。
(4)利用上述表格数据,计算Ni(OH) 2的K sp= (列出计算式)。如果"转化"后的溶液中Ni 2+浓度为1.0mol•L ﹣ 1,则"调pH"应控制的pH范围是 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH.写出该反应的离子方程式 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是 。
氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备
KClO 3和NaClO,探究其氧化还原性质。

回答下列问题:
(1)盛放MnO 2粉末的仪器名称是 ,a中的试剂为 。
(2)b中采用的加热方式是 。c中化学反应的离子方程式是 ,采用冰水浴冷却的目的是 。
(3)d的作用是 ,可选用试剂 (填标号)。
A.Na 2S B.NaCl C.Ca(OH) 2D.H 2SO 4
(4)反应结束后,取出b中试管,经冷却结晶, , ,干燥,得到KClO 3晶体。
(5)取少量KClO 3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl 4振荡,静置后CCl 4层显 色。可知该条件下KClO 3的氧化能力 NaClO(填"大于"或"小于")。
苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
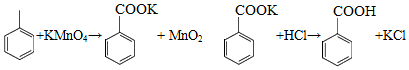
名称 |
相对分子质量 |
熔点/℃ |
沸点/℃ |
密度/(g•mL﹣1) |
溶解性 |
甲苯 |
92 |
﹣95 |
110.6 |
0.867 |
不溶于水,易溶于乙醇 |
苯甲酸 |
122 |
122.4(100℃左右开始升华) |
248 |
﹣﹣ |
微溶于冷水,易溶于乙醇、热水 |
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5mL甲苯、100mL水和4.8g (约0.03mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0g。
(3)纯度测定:称取0.122g粗产品,配成乙醇溶液,于100mL容量瓶中定容。每次移取25.00mL溶液,用0.01000mol•L﹣1的KOH标准溶液滴定,三次滴定平均消耗21.50mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为 (填标号)。
A.100mL B.250mL C.500mL D.1000mL
(2)在反应装置中应选用 冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是 。
(3)加入适量饱和亚硫酸氢钠溶液的目的是 ;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理 。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是 。
(6)本实验制备的苯甲酸的纯度为 ; 据此估算本实验中苯甲酸的产率最接近于 (填标号)。
A.70% B.60% C.50% D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中 的方法提纯。
化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许 离子通过,氯气的逸出口是 (填标号)。
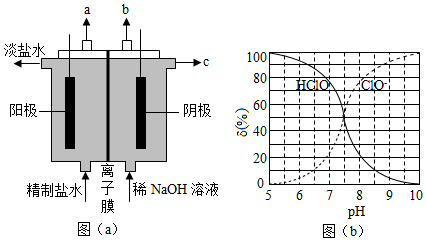
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X) ,X为HClO或ClO ﹣]与pH的关系如图(b)所示。HClO的电离常数K a值为 。
(3)Cl 2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl 2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl 2O的化学方程式为 。
(4)ClO 2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO 2、NaHSO 4、NaHCO 3的"二氧化氯泡腾片",能快速溶于水,溢出大量气泡,得到ClO 2溶液。上述过程中,生成ClO 2的反应属于歧化反应,每生成1mol ClO 2消耗NaClO 2的量为 mol;产生"气泡"的化学方程式为 。
(5)"84消毒液"的有效成分为NaClO,不可与酸性清洁剂混用的原因是 (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为 kg(保留整数)。
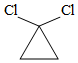
有机碱,例如二甲基胺(  )、苯胺(
)、苯胺( 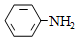 )、吡啶(
)、吡啶(  )等,在有机合成中应用很普遍,目前"有机超强碱"的研究越来越受到关注。以下为有机超强碱F的合成路线:
)等,在有机合成中应用很普遍,目前"有机超强碱"的研究越来越受到关注。以下为有机超强碱F的合成路线:

已知如下信息:
①H 2C=CH 2
② 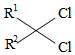 +RNH 2
+RNH 2

③苯胺与甲基吡啶互为芳香同分异构体
回答下列问题:
(1)A的化学名称为 。
(2)由B生成C的化学方程式为 。
(3)C中所含官能团的名称为 。
(4)由C生成D的反应类型为 。
(5)D的结构简式为 。
(6)E的六元环芳香同分异构体中,能与金属钠反应,且核磁共振氢谱有四组峰,峰面积之比为6:2:2:1的有 种,其中,芳香环上为二取代的结构简式为 。
Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe 2+与Fe 3+离子中未成对的电子数之比为 。
(2)Li及其周期表中相邻元素的第一电离能(I 1)如表所示。I 1(Li)>I 1(Na),原因是 。 I 1(Be)>I 1(B)>I 1(Li),原因是 。
| I 1/(kJ•mol ﹣ 1) |
||
| Li 520 |
Be 900 |
B 801 |
| Na 496 |
Mg 738 |
Al 578 |
(3)磷酸根离子的空间构型为 ,其中P的价层电子对数为 、杂化轨道类型为 。
(4)LiFePO 4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO 4的单元数有 个。
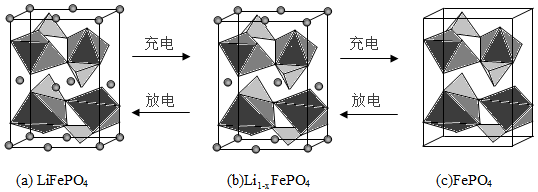
电池充电时,LiFePO 4脱出部分Li +,形成Li 1 ﹣ xFePO 4,结构示意图如(b)所示,则x= ,n(Fe 2+):n(Fe 3+)= 。
硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO 2的催化氧化:SO 2(g) O 2(g) SO 3(g)△H=﹣98kJ•mol ﹣ 1.回答下列问题:
(1)钒催化剂参与反应的能量变化如图(a)所示,V 2O 5(s)与SO 2(g)反应生成VOSO 4(s)和V 2O 4(s)的热化学方程式为: 。
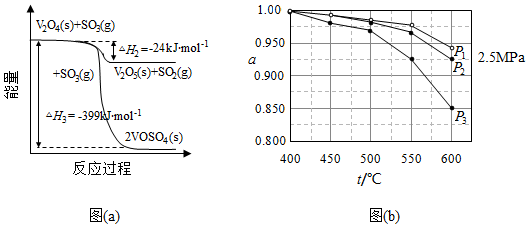
(2)当SO 2(g)、O 2(g)和N 2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO 2平衡转化率α随温度的变化如图(b)所示。反应在5.0MPa、550℃时的α= ,判断的依据是 。影响α的因素有 。
(3)将组成(物质的量分数)为2m% SO 2(g)、m% O 2(g)和q% N 2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO 2转化率为α,则SO 3压强为 ,平衡常数K p= (以分压表示,分压=总压×物质的量分数)。
(4)研究表明,SO 2催化氧化的反应速率方程为:v=k( 1) 0.8(1﹣nα′)式中:k为反应速率常数,随温度t升高而增大;α为SO 2平衡转化率,α′为某时刻SO 2转化率,n为常数。在α′=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图(c)所示。

曲线上v最大值所对应温度称为该α′下反应的最适宜温度t m.t<t m时,v逐渐提高;t>t m后,v逐渐下降。原因是 。
为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
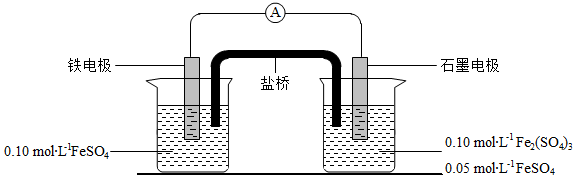
回答下列问题:
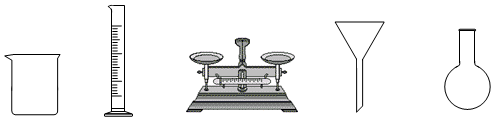
(1)由FeSO 4•7H 2O固体配制0.10mol•L ﹣ 1FeSO 4溶液,需要的仪器有药匙、玻璃棒、 (从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u ∞)应尽可能地相近。根据下表数据,盐桥中应选择 作为电解质。
| 阳离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
阴离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
| Li + |
4.07 |
HCO 3 ﹣ |
4.61 |
| Na + |
5.19 |
NO 3 ﹣ |
7.40 |
| Ca 2+ |
6.59 |
Cl ﹣ |
7.91 |
| K + |
7.62 |
SO 4 2 ﹣ |
8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入 电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe 2+)增加了0.02mol•L ﹣ 1.石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe 2+)= 。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为 ,铁电极反应式为 。因此,验证了Fe 2+氧化性小于 ,还原性小于 。
(6)实验前需要对铁电极表面活化。在FeSO 4溶液中加入几滴Fe 2(SO 4) 3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是 。
羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。制备少量羟基乙酸钠的反应为ClCH2COOH+2NaOH→HOCH2COONa+NaCl+H2O△H<0
实验步骤如下:
步骤1:在如图所示装置的反应瓶中,加入40g氯乙酸、50mL水,搅拌。逐步加入40% NaOH溶液,在95℃继续搅拌反应2小时,反应过程中控制pH约为9。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15℃以下,结晶、过滤、干燥,得羟基乙酸钠。
(1)步骤1中,如图所示的装置中仪器A的名称是 ;逐步加入NaOH溶液的目的是 。
(2)步骤2中,蒸馏烧瓶中加入沸石或碎瓷片的目的是 。
(3)步骤3中,粗产品溶解于过量水会导致产率 ( 填“增大”或“减小”);去除活性炭的操作名称是 。
(4)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是 。

以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2].
(1)Fe基态核外电子排布式为 ;[Fe(H2O)6]2+中与Fe2+配位的原子是 (填元素符号).
(2)NH3分子中氮原子的轨道杂化类型是 ;C、N、O元素的第一电离能由大到小的顺序为 .
(3)与NH4+互为等电子体的一种分子为 (填化学式).
(4)柠檬酸的结构简式如图.1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为 mol.

CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO﹣,其离子方程式为 ;其他条件不变,HCO3﹣转化为HCOO﹣的转化率随温度的变化如图1所示。反应温度在40℃~80℃范围内,HCO3﹣催化加氢的转化率迅速上升,其主要原因是 。

(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图2所示,两电极区间用允许K+、H+通过的半透膜隔开。
①电池负极电极反应式为 ;放电过程中需补充的物质A为 (填化学式)。
②如图2所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为 。
(3)HCOOH催化释氢。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图3所示。
①HCOOD催化释氢反应除生成CO2外,还生成 (填化学式)。
②研究发现:其他条件不变时,以HCOOK溶液代替HCOOH催化释氢的效果更佳,其具体优点是 。
实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料α﹣Fe2O3.其主要实验流程如图。

(1)酸浸。用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有 (填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原。向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+.“还原”过程中除生成Fe2+外,还会生成 (填化学式);检验Fe3+是否还原完全的实验操作是 。
(3)除杂。向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低,将会导致CaF2沉淀不完全,其原因是 [Ksp(CaF2)=5.3×10﹣9,Ka(HF)=6.3×10﹣4]。
(4)沉铁。将提纯后的FeSO4溶液与氨水﹣NH4HCO3混合溶液反应。生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为 。
②设计以FeSO4溶液、氨水﹣NH4HCO3混合溶液为原料,制备FeCO3的实验方案: [FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5]。
苯佐卡因是临床常用的一种手术用药。以甲苯为起始原料的合成路线如图。
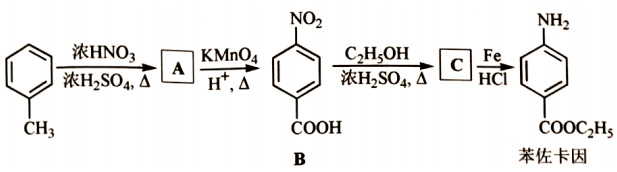
回答问题:
(1)甲苯分子内共面的H原子数最多为 个。
(2)A的名称是 。
(3)在A的同分异构体中,符合下列条件的是 ( 写出一种结构简式)。
①与A具有相同官能团
②属于芳香化合物
③核磁共振氢谱有5组峰
(4)B中官能团名称为 。
(5)B→C的反应方程式为 。
(6)反应过程中产出的铁泥属于危化品,处理方式为 ( 填编号)。
a.高温炉焚烧
b.填埋
c.交有资质单位处理
(7)设计以甲苯和丙三醇为原料合成3﹣苄氧基﹣1,2﹣丙二醇(  )的路线 (其他试剂任选)。
)的路线 (其他试剂任选)。
已知:在于HCl催化下丙酮与醇ROH反应生成缩酮。缩酮在碱性条件下稳定。在酸中水解为丙酮和醇ROH。
试题篮
()