右图A→E是五种中学化学常见物质其中A、B、C、D常温下都是气体,B 为红棕色,A为气体单质。
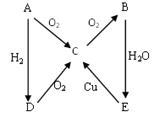
(1)写出化学式:B C
(2)实验室制备D实验中所用的干燥剂是: 。
(3)B与H2O反应,该反应的氧化剂和还原剂的物质的量之比为 。
(4)A与O2的反应方程式: ;D与O2的反应方程式:
;A与H2的反应方程式: 。
乙醇经下列步骤反应合成化合物C(分子式为C4H8O2),已知C是环状化合物且不能使溴水、KMnO4(H+)溶液褪色,反应路线如下:

(1)写出A.C结构简式:A , C ;
(2)写出x、y的反应类型:x 、y 。
根据下面物质间转换的框图,回答有关问题:

(1)写出框图中物质A、D、F、G分别指代物质的化学式:
A. D. F. G.
(2)写出⑤反应的化学方程式 。
在⑤反应中当有6.6gD 足量的Na2O2参加反应时会造成固体增重 克 。
(3)写出④的离子反应方程式 。
[化学—物质结构与性质]
A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,B原子核外的L层电子数是K层的两倍,C是地壳内含量(质量分数)最高的元素,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)A、B的元素符号依次为_____________、_______________;
(2)AC2与BC2分子的立体结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是___________________________________________;
(3)D的核外电子排布式为________________________,在形成化合物时它的最高化合价为__________。
某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。

请回答下列问题。
(1) 图中涉及分离溶液与沉淀的方法是__________________。
(2) B、C、D、E 4种物质的化学式为:B_________、C_________、D_________、E_________。
(3)沉淀F与NaOH溶液反应的离子方程式为
沉淀E与稀硫酸反应的离子方程式为
溶液G与过量稀氨水反应的化学方程式为
针对下面9种元素,完成以下各小题
| 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
|
ⅥA |
ⅦA |
O |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
⑤ |
⑥ |
⑦ |
|
⑧ |
⑨ |
|
(1)单质为有色气体的元素是___________(填名称)。
(2)③④⑤简单离子的半径由大到小的顺序为_____________(填离子符号)。
(3)元素②的单质的电子式为________________。
(4)最高价氧化物对应的水化物酸性最强的是___________________。(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为_____________。
(6)⑦的单质的用途正确的是___________。
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是__________,写出一个能表示二者非金属性强弱关系的化学方程式为:______________。
框图所示的转化关系中,A、C均为常见的金属单质,A、C在冷的H的浓溶液中均会发生钝化;E为固体非金属单质。B为红色固体氧化物,X为常见的无色液体.L焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)

请回答以下问题:
(1)含碳量在0.03%~2%之间的C的合金,是目前世界上使用量最大的合金,这种合金是 ;
A.铝合金 B.青铜 C.镁合金 D.钢铁
(2)F的化学式为 ;
(3)K与氨水反应的离子方程式为 ;
(4)A与B生成C和D的反应是 (填“放出”或“吸收”)大量热量的反应;
(5)D与L反应的离子方程式为 。
某不锈钢(主要成分为Fe)样品中含有铝、铜等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程:

(1)滤液C中溶质含有_ _(写化学式);
(2)反应②的离子方程式为: ,如何验证滤液A中含Fe2+,而不含Fe3+____ _____。
(3)对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素质量分数的表达式为(用含a、b的式子表示)___ __。
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+、Na+、Al3+、Cu2+ |
| 阴离子 |
OH-、HCO3-、NO3-、SO42- |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象。
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、C的化学式:B ;C 。
(2)写出过量E滴人到C溶液中的离子反应方程式 。
(3)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(4)在A溶液中加澄清石灰水,其离子方程式为 。
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间最终变为C,B和气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出下列物质的化学式:B ,C ,D ,E 。
(2)写出下列反应的离子方程式:
①A和水生成E:
②B和水生成E:
③E与D生成C:
(3) ①B物质是否属于电解质 (填:是、否)
②B物质是否属于碱性氧化物 (填:是、否)
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为 ;其水溶液中离子浓度由大到小的顺序是 。
(3)X的硝酸盐水溶液显 性,用离子方程式解释原因 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式 。
下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
填写下列空白:
(1)写出化学式:A________,B_________,D_________E_______。
(2)以上反应中不属于氧化还原反应的有______________(填序号)。
(3)写出反应②④⑥的化学方程式:
②_______________________________。
④_______________________________。
⑥_______________________________。
(4)写出反应⑤的离子方程式:_____________________,写出铝粉和C溶液反应的离子方程式:___________________
下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题:
| |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
① |
|
|
|
|
|
|
|
| 2 |
② |
③ |
|
④ |
⑤ |
⑥ |
⑦ |
|
| 3 |
⑧ |
|
|
|
|
⑨ |
⑩ |
|
(1)自然界物质种类最多的元素在周期表中的位置是_____________________
(2)⑧⑨⑩的离子半径由大到小的顺序为 (填化学用语)。
(3)写出由⑥、⑧、⑩元素形成的一种离子化合物的电子式_____________________
(4)②的最高价氧化物对应的水化物与盐酸反应的离子方程式____________________
(5)根据斜线性质相似规则,③的氧化物,氢氧化物有两性,写出③的单质与⑧的最高价氧化物的水化物反应的化学方程式___________________________
(6)已知W+X=Y+Z,W、X、Y、Z分别是由①⑤⑥三种元素形成的四种十电子粒子,
写出该反应式__________________________
已知:溶液E焰色反应为黄色。
根据以上转化关系,回答下列问题:
(1)写出下面物质的化学式:
A______________,B____________,C_______________,D_____________。
(2)写出下列离子方程式:
(Ⅰ)___________________________;
(Ⅱ)___________________________;
(Ⅲ)___________________________;
(Ⅳ)_______________________________。
试题篮
()