已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为 ;E元素的最高价氧化物分子的立体构型是 。F元素原子的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由 。
(3)A、G形成某种化合物的晶胞结构如图所示 。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
(4)在1.0l×105 Pa、t1℃时,气体摩尔体积为53.4 L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的组成为(写化学式) 。
氧氮杂环是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改善脑缺血等性质。下面是某研究小组提出的一种氧氮杂环类化合物H的合成路线:
(1)原料A的同分异构体中,含有苯环、且核磁共振氢谱中有4个峰的是______(写出其结构简式)。
(2)③的反应类型是______。原料D中含有的官能团名称是______、______。
(3)反应②的化学方程式是______________________________。
(4)原料B俗名“马来酐”,它是每来酸(顺丁烯二酸: )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( )和聚合物Q:
)和聚合物Q:
①半方酸是原料B的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含 -O-O-键。半方酸的结构简式是____________。
②写出反应I和反应II的化学方程式_____________、____________。
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1 : 1的化合物N是常见的有机溶剂。
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为______,E的基态原子的外围电子排布式为______。
(2)B、C、D三种元素的第一电离能由小到大的顺序为______。
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为______
(4)下列叙述正确的是______(填序号)。
a. M是极性分子,N是非极性分子 b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键 d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5) 已知:①E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g) △H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:__________________________
(6)在0.5 L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g) +3 A2(g)=2CA3(g) △H<0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
①试比较K1,K2的大小,K1________K2(填写“ >”、“=”或“<”)。
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1 mol、2 mol时,则该反应的 V(C2)正_________(C2)逆(填写“>”、“=”或“<”)。
已知:I.质谱分析测得有机化合物A的相对分子质量为92.5,含有碳、氢、氯三种元素,且 氢的质量分数为9.73%0
Ⅱ.A有如下的转化关系
III.与羟基相连的碳上没有氢原子的醇(结构: )不能氧化成醛或酮。
)不能氧化成醛或酮。
Ⅳ.F的核磁共振氢谱有两种吸收峰,其峰面积之比为9:1.
V.E和G都能和新制的Cu(OH)2悬浊液反应,但反应类型不同,H是一种具有果香味的液体。
根据以上信息回答下列问题
(1)A的分子式为 ,A的结构简式为 。
(2)E的官能团为 (写化学式),反应⑦的反应类型为 。
(3)D还有两种相同类别的同分异构体在Ⅱ中没有出现,它们的结构简式分别为 和 。
(4)在B的同分异构体中存在顺反异构现象,请写出其反式异构体的结构简式并命名:
、 。
(5)写出下列反应的化学方程式:
反应⑤ 。
反应⑧ 。
(6)若M的分子式为C4H2Cl8,若不考虑立体异构,其同分异构体有 种。
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大。W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍。请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
(l)W、Y、Z 三种元素的第一电离能由大到小的顺序为 。在上述三种元素的原子中,写出与WZ2互为等电子体的分子式 。
(2)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键)
该分子中Y原子的杂化方式是 杂化。
(3)W2-2阴离子的电子式为 ,Z原子最外层电子排布式为 。
(4)YQ3分子的空间构型为 ,Y和Q两元素的氢化物的沸点相比较,高者是 (写分子式).往硫酸铜溶液中通入过量的YH3(Y的氢化物分子式),可生成配离子[Cu(YH3)4]2+,但YQ3不易与Cu2+形成配离子,其原因是 。
(5)科学家通过X射线探明RZ的晶体结构与NaCl晶体结构相似。那么在RZ晶体中距离R2+最近且等距离的R2+有 个。若在RZ晶体中阴阳离子间最近距离为a cm,晶体密度为ρg/cm3,则阿伏伽德罗常数NA的表达式为 mol-1。
(6)已知非整数比化合物R0.95Z,其晶体结构与NaCI相似,但由于R、Z离子个数比小于1:1,故晶体存在缺陷。R0.95Z可表示为( )
下图中A、B、C、D、E均为有机化合物。已知:C能与NaHCO3溶液发生反应,C
和D的相对分子质量相等,且D催化氧化的产物不能发生银镜反应。
回答下列问题:
(1)C分子中官能团的名称是__________;化合物B不能发生的反应是_________。(填字母序号) a.加成反应b.水解反应c.消去反应d.酯化反应
(2)写出E的结构简式______________________________________。
(3)写出反应①的化学方程式:_____________________________________________。
(4)同时符合下列三个条件的B的同分异构体有多种:
a.苯环上有二个取代基且苯环上的一氯代物有2种
b.能与FeCl3溶液发生显色反应
c.能发生水解反应
试写出lmol B的同分异构体中,能与3molNaOH反应的结构简式_______________。
A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为_______;
(2)B元素的负一价离子的电子层结构与氩相同,C元素的正一价禽子的电子层结构与氙相同,B、C形成的化合物的化学式为________;其晶体内每个B离子周围有_____个C离子与之紧相邻。其晶体的主要物理性质有:___________________________________(写出两条即可)。
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为______,其基态原子的电
子排布式为___________________________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其单质在一定条件下能与硫(S)反应,试写出该反应方程式 _____________________________。
下列是利用烃C3H6合成有机高分子E和C6H14的流程图,请回答以下问题:
(1)①〜⑥中属于取代反应的有_______________;
(2)C6H14核磁共振谱只有两种峰,则C6H14的结构简式为:_________________,
写出E的结构简式:___________________;
(3)写出B与新制Cu(OH)2悬浊液反应的化学方程式:________________________;
(4)D的同分异构体很多,符合下列条件的同分异构体有___种,其中氢原子核磁共振谱谱峰最少的结构简式为_______。
①含碳碳双键 ②能水解 ③能发生银镜反应
(5)根据你所学知识和上图中相关信息,以乙醇为主要原料通过三步可能合成环己烷(无机试剂任选),写出第一步和第三步化学反应的化学方程式(有机物质写结构简式):
________________________________、________________________________________。
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的价电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 。
(2)已知:①E-E→2E·;△H=+a kJ·mol-1
② 2A·→A-A;△H=-b kJ·mol-1
③E·+A·→A-E;△H=-c kJ·mol-1(“·”表示形成共价键所提供的电子)
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 |
甲 |
乙 |
丙 |
| 初始投料 |
2 molA2、1 molBC |
1 molX |
4 molA2、2 molBC |
| 平衡时n(X) |
0.5mol |
n2 |
n3 |
| 反应的能量变化 |
放出Q1kJ |
吸收Q2kJ |
放出Q3kJ |
| 体系的压强 |
P1 |
P2 |
P3 |
| 反应物的转化率 |
α1 |
α2 |
α3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则该时间段内A2的平均反应速率v(A2) 。
②该温度下此反应的平衡常数K的值为 。
③三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
双酚A (也称BPA)常用来生产防碎塑料聚碳酸酯。BPA的结构简式如下图所示。
(1)双酚A中的含氧官能团为______(填名称)。
(2)下列关于双酚A的叙述中,不正确的是______(填标号)。
A.遇FeCl3溶液变色
B.可以发生还原反应
C.1mol双酚A最多可与2molBr2反应
D.可与NaOH溶液反应
(3)双酚A的一种合成路线如下图所示:
①丙烯→A的反应类型是____________。
②B→C的化学方程式是__________________。
③D的结构简式是____________。
(4)双酚A制取聚碳酸酯的过程中需要用到碳酸二甲酯( )。有机物W是碳酸二甲酯的同分异构体,W具有如下特征:
)。有机物W是碳酸二甲酯的同分异构体,W具有如下特征:
i.只含l个甲基
ii.能分别与乙酸、乙醇发生酯化反应
写出W与乙酸反应的化学方程式:________________________。
某铵态氮肥由W、X、Y、Z等4种短周期元素组成,其中W的原子半径最小。
I.若Y、Z同主族,ZY2是形成酸雨的主要物质之一。
(1)将X、Y、Z的元素符号填在右图所示元素周期表(局部)中的相应位置上。
(2)X的最髙价氧化物对应水化物的稀溶液与铜反应的化学方程式为___ ___。
(3)一定条件下,1mol XW3气体与O2完全反应生成X元素的单质和液态水,放出382.8 kJ热量。该反应的热化学方程式为________________________。
II.若Z是形成化合物种类最多的元素。
(4)该氮肥的名称是______(填一种)。
(5)HR是含Z元素的一元酸。室温时,用0.250mol•L—1NaOH溶液滴定25.0 mL HR溶液时,溶液的pH变化情况如图所示。其中,a点表示两种物质恰好完全反应。
①右图中x______7(填“>”、“<”或“=”)。
②室温时,HR的电离常数Ka=______(填数值)。
某有机物G分子结构的球棍模型如下图所示(图中小球分别表示碳、氢、氧原子,球与球之间的连线“一”不一定是单键)。用芳香烃A为原料合成G的路线如下:
试回答:
(1)G的分子式为_______;G中环状基团被氢原子取代后的有机物名称为_______。
(2)A的结构简式为______;D中官能团的名称为_______。
(3)B→C反应的化学方程式是____________________________;
E→F反应的化学方程式是____________________________。
(4)E的同分异构体中可用通式 表示(其中X、Y均不为H),且能发生银镜反应的物质有_______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可) ________________。
表示(其中X、Y均不为H),且能发生银镜反应的物质有_______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可) ________________。
X、Y、Z、T、W五种元素的性质或原子结构如下表:
| 元素 |
元素性质或原子结构 |
| X |
原子的最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z |
基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
| T |
与Z同周期,元素最高价是+7价 |
| W |
原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_______;W元素基态原子电子排布式为________________________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是______________。
A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的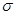 键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
(4)①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4. 4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为______________。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化曲线如下图所示: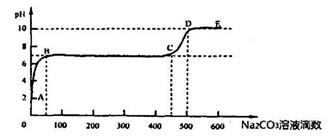
请用离子方程式表示BC段、CD段发生的反应:
BC段:__________________________________________;
CD段:__________________________________________。
I.物质A为生活中常见的有机物,只含有C、H、O三种元素,已知该有机物的蒸气密度是相同条件下H2密度的23倍,其中氧元素的质量分数为34.8%,且有如下的转化关系:
(1)由A→B的反应类型是 。
(2)D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键,反应①中D与HCl按物质的量之比1:l反应,原子利用率为100%,则D的结构简式是 。
II.化合物E和F是药品普鲁卡因合成的重要原料。普鲁卡因的合成路线如下:
(3)由甲苯生成物质甲的化学方程式为 。
(4)丁的结构简式为 。
(5)反应③的化学方程式是 。
(6)普鲁卡因有两种水解产物戊和己,且戊与甲具有相同的分子式。符合下列条件的戊的同分异构体有 种(包含戊)。
a.分子结构中含苯环,且每个苯环有2个侧链
b.分子结构.中一定含官能团—NH2,且—NH2直接与碳原子相连
戊经聚合反应可制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是 。
Q、R、X、Y、Z(Q、R、X、Y、Z分别代表元素符号)五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是 ;在[Z(NH3)4]2+离子中,Z2+的空间轨道接受NH3分子提供的 形成配位键。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,财甲、乙的稳定性大小为 > ,甲、乙的沸点大小为 < (均用相应的化学式表示)。
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序为 < < (用元素符号作答);Q的一种氢化物相对分子质量为26,其中分子中的 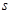 键与π键的键数之比为 。
键与π键的键数之比为 。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
试题篮
()