物质A、B、C、D、E、F、G、H、I、J有如图所示的转化关系。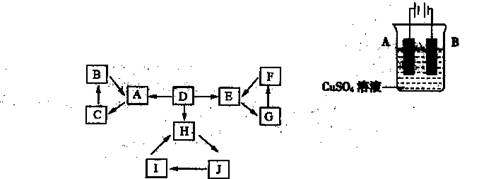
图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素。其它信息见下表:
| 编号 |
信 息 |
| 1 |
D为地壳中含量最高的元素组成的单质 |
| 2 |
E为酸性气态氧化物 |
| 3 |
F的浓溶液常做干燥剂 |
| 4 |
H为淡黄色固体化合物 |
| 5 |
电解饱和J溶液是工业重要反应 |
| 6 |
C为离子化合物,阴、阳离子均含有金属元素 |
(1)写出G的化学式: ,指出H中化学键的类型: 。
(2)常温下测得一定浓度的C溶液的pH=10,用离子方程式表示其原因 。
(3)写出与H相对分子质量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的化学式 。
(4)写出C溶液中通入过量CO2的化学方程式: 。 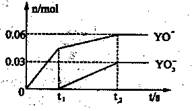
(5)通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中三种含Y元素的离子,其中两种离子物质的量(n)与反应时间(t)的变化示意图如上图所示,写出该反应的离子方程式是 ,该苛性钾溶液中KOH的质量是 g。
用作软质隐形眼镜材料的聚合物E是:
一种合成聚合物E的路线如下:
回答下列问题:
(1)A能与新制Cu(OH)2悬浊液反应产生砖红色沉淀,A的结构简式是 ;
(2)D中含有的官能团名称为 ;
(3)D→E的反应类型是 反应;
(4)C有多种同分异构体。属于酯且含有碳碳双键的同分异构体共有 种(不考虑顺反异构),写出其中核磁共振氢谱峰面积之比为1:1:1:3的同分异构体的结构简式 ;
(5)写出由乙烯合成乙二醇的化学方程式。 。
下图转化中的字母只代表一种单质或化合物,A是淡黄色固体,B为金属单质,J是白色胶状沉淀,常温下X是液体,C、D、Y均为气体。请回答下列问题:
(1)写出化学式: B X
(2)A中存在的化学键类型 H的俗名 Y的电子式
(3)写出下列方程式
反应①的化学方程式
反应②的离子方程式
某蓝色荧光材料F的合成路线如下:
(1)化合物B中含有的含氧官能团的名称是 。
(2)写出化合物CH3NCS的结构式: 。
(3)合成路线中属于加成反应的反应有 。(填序号)
(4)反应③另一产物为甲醇,其化学方程式为 。
(5)与A具有相同的含氮六元环和官能团的同分异构体共有 种(包含本身。已知含氮六元环与苯环结构相似)。
(6)已知: 。请写出以
。请写出以 和甲醇为主要原料制备
和甲醇为主要原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH  CH2=CH2
CH2=CH2 BrCH2—CH2Br
BrCH2—CH2Br
有机物A是分子式为C7H8O2的五元环状化合物,它具有四种不同化学环境的氢,其原子个数比为3:1:2:2它能发生如下转化:
根据以上信息,试回答下列问题:
(1)写出化合物A中官能团的名称 。
(2)写出化合物B、F的结构简式B F 。
(3)A→B的反应类型是 ,F→G的反应类型是 。
(4)①写出D与CH4O反应的化学方程式 。②写出F→G的反应的化学方程式 。
(5)写出化合物A的符合下列条件的同分异构体 。
①属于芳香族化合物 ②能与碳酸钠溶液反应 ③属于醇类化合物
下表为部分短周期元素化合价及其相应原子半径的数据。请回答下列问题: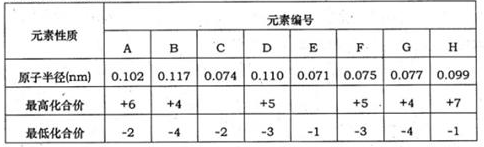
(1)元素G在周期中的位置是 ;元素F所形成的常见单质的电子式为 。
(2)A、B、C、E的氢化物稳定性顺序是 。(用化学式回答)
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是 。
(4)请写出B的单质的一种重要用途 ;工业上制取该单质的原理反应为 。
(5)请设计一个实验方案,使铜和A的最高价氧化物对应的水化物的稀溶液反应,得到蓝色溶液和氢气。请在方框内绘出该实验方案原理装置示意图。
已知:在一定条件下,有如下反应可以发生
某一试剂瓶的标签严重破损,只能隐约看到下列一部分:
取该试剂瓶中的试剂,通过燃烧实验测得:16.6g该物质完全燃烧得到39.6gCO2与9gH2O。进一步实验可知:①该物质能与碳酸氢钠溶液反应生成无色无味气体。②16.6g该物质与足量金属钠反应可生成氢气2.24L(已折算成标准状况)。请回答:
(1)该有机物的分子式 ______。该有机物的结构可能______种。
(2)若下列转化中的D是上述有机物可能结构中的一种,且可发生消去反应;E含两个六元环;F是高分子化合物;取C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液,出现白色沉淀。
①A的结构简式为____________;
②写出A转化成B的化学方程式____________
③写出由D制取F的化学方程式____________。
④反应类型:D→ E____________
A-E是周期表中1一36号的元素,它们的原子序数依次递增且分别位于前四周期的各个周期中。对它们的性质及结构的描述如下。
A原子的基态只有一种形状的电子云,并容易形成共价键;B原子的最外电子层的电子排布可表示为nsnnpn,其元素最高正化合价与最低负化合价的代数和为0;C与B同周期,其第一电离能髙于周期表中与之相邻的所有元素;D元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大;E原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素。
(1)请写出E原子基态的电子排布式____________。
(2)A与C形成的最简单化合物(甲)分子的立体结构是____________,其中C原子的杂化方式是______
(3)A与D元素形成的化合物(乙)与甲相比,沸点较低的是(写化学式)____________原因是________________________
(4)B元素可形成B70单质,它在一定条件下吸收可见光后可高效杀灭癌细胞,有望成为癌症治疗药物的候选材料。它与金属钾掺杂在一起的化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),则该化合物中B70与钾原子个数比为______。
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
Ⅰ.原子半径:A < C < B < E< D
Ⅱ.原子的最外层电子数:A = D C= E A + B = C
Ⅲ.原子的核外电子层数:B =" C" = 2A
Ⅳ.B元素的主要化合价:最高正价 + 最低负价 = 2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式 ;
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式: 。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。单质F发生 (填电化学腐蚀类型)
(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为 ,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为 。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2。则该复
盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象
。
以 HCHO 和 C2H2为有机原料,经过下列反应可得化合物 N ( C4H8O2)。
(1)反应Ⅰ的反应类型为 。
(2)HOCH2C≡CCH2OH 分子中,在同一个平面的原子最多有 个。
(3)化合物 M 不可能发生的反应是 (填序号)。
| A.氧化反应 | B.取代反应 | C.消去反应 | D.加成反应 E.还原反应 |
(4)N 的同分异构体中,属于酯类的有 种。
(5)A 与 M 互为同分异构体,有如下转化关系。其中E的结构简式为

填写下列空白:
① A 的结构简式为 ,B 中的官能团名称是 。
② D 的分子式为 。
③ 写出 B 与银氨溶液反应的化学方程式:_ 。
下图为元素周期表的一部分,请参照元素①一⑧在表中的位置,回答下列问题
(1)元素⑧形成的简单阴离子的结构示意图为____;元素④、⑥、⑦形成的简单离子的半径由大到小的顺序是 (用离子符号表示)。
(2)元素③和④可以形成多种化合物,其中化合物甲为这些化合物中相对分子质量最小的。若将化合物甲与元素④的单质按物质的量之比为4:1通人含足量由元素①、④和⑥组成的化合物乙的水溶液中,气体恰好完全反应且生成的盐只有一种,其反应的化学方程式为________。
(3)元素②和④组成的一种化合物与元素④的单质和化合物乙的水溶液在一定条件下可形成燃料电池,写出该燃料电池负极的电极反应式 .
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
①X溶液与Y溶液反应的离子方程式为___ _。
②N→⑦的单质反应的化学方程式为___ _。
③M的水溶液显酸性,用离子方程式解释其原因___ _。
下表为元素周期表的一部分,请参照元素在表中的位置,回答下列问题(凡能用化学用语的必须用相应的化学用语回答):
(1)用原子符号表示中子数为8的编号为③的原子____,以上元素中原子的电子层数等于最外层电子数的元素为____,⑤、⑥、⑦、⑧三元素的简单离子半径由大到小的顺序为 。
(2)②①④三种元素能按原子个数比1:2:1形成一种在室内装修过程中常见的气体污染物。该气体分子的中心原子的杂化轨道类型为____,1mol该分子中π键的数目为____。
(3)写出⑥的单质在④的单质中燃烧产生的化合物的电子式 ,该化合物与足量⑨的低价硫酸盐溶液反应的离子方程式 。
(4)同主族元素的单质及化合物在许多性质上都存在着递变规律。下图是①、⑤、⑧、⑩的单质及①分别和⑤、⑧、⑩形成的化合物的键能大小。
由图中键能数据推断得知:①—R键(R表示⑤、⑧、⑩)的键能随分子中键长的增长而 (填“增大”或“减小”)。同主族元素随着原子序数的递增,非金属元素的单质分子中化学键的键长逐渐增大,键能____(填“一定减小”或“不一定减小”)根据图中键能数据,写出①的气态单质在⑧的气态单质中燃烧的热化学方程式____。
某有机物A(C8H13O2Br)在一定条件下可分别生成B1+C1和B2+C2。各物质之间的转化关系如图所示:
(1)C2的名称为 ,B1属于下列化合物中的 (填序号)。
①一元醇 ②二元醇 ③卤代烃 ④醛 ⑤饱和羧酸 ⑥不饱和羧酸
(2)写出下列化学反应类型:反应① ;反应② 。
(3)在不同的条件下,C2和J发生化学反应可以生成多种有机物I,请写出满足下列条件的两种I的结构简式:
①C2和J按物质的量之比为1:1反应生成的最小环状化合物 。
②C2和J按物质的量之比为1:1反应生成的链状高分子 。
(4)写出③的化学反应方程式 。
(5)满足如下条件的有机物有 种(不考虑手性异构)。
①与C2相对分子质量相同;
③该物质分子中含两种不同的官能团,且Imol该物质能与金属钠反应生成1mol氢气。
(6)有机物M(C3H6O)的核磁共振氢谱显示只有一种氢,由M为有机原料也可制得有机玻璃H。请参考以下信息,写出用M和甲醇为原料(其它无机试剂任选)制备有机玻璃H的合理流程图。
有五种原子序数在36以内的元素A、B、C、D、E,它们的原子序数依次增大,A原子的最外层电子数等于其电子层数,A、B、C原子核外电子层数之和是6,C原子的电子数为A和B两元素原子电子总数的两倍;D和C的最高价氧化物对应水化物的酸性前者强于后者;E可和C形成原子个数比为1:1和1:2的两种化合物,其中一种物质是工业合成硫酸的常见原料,这两种化合物的摩尔质量相差32。试回答下列问题:
(1)E在周期表中的位置是 ,基态B原子的价电子排布式 。
(2)写出CD2的电子式 ,根据价层电子对互斥(VSEPR)理论推测,CD2分子的空间构型为 ,该分子是 分子(填“极性”或“非极性”)。
(3)通常情况下,AB3为无色有刺激性气味的液体,沸点303.8K,熔点193K。AB3固态时的晶体类型为 ;其水溶液有弱酸性,它的电离方程式为 。
(4)下列性质可作为比较C、D两元素非金属性强弱依据的是 (填编号)。
①C、D的最高价氧化物对应水化物的酸性强弱
②C、D的气态氢化物的水溶液的酸性强弱
③C、D的气态氢化物的稳定性强弱
④C、D的简单离子是否易被E3+氧化
⑤相同条件下,C、D的钠盐溶液的碱性强弱
合成涤纶的流程图如下所示。
回答下列问题:
(1)A的名称为 ;
(2) F的结构简式是 ;
(3) C→D的反应类型是 ;F→G的反应类型为 ;
(4)E与H反应的化学方程式为 :
(5)E有多种同分异构体,符合下列条件的同分异构体有 种,其中在核磁共振氢谱中出现四组峰的是 (写出结构简式)。
①芳香族化合物;②红外光谱显示含有羧基;③能发生银镜反应;④能发生水解反应
(6) A也能一步转化生成E: .试剂a可以用 溶液。
.试剂a可以用 溶液。
试题篮
()