结构决定性质,性质决定用途;已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,Z的单质在常温下均为无色气体,W原子的最外层电子排布是nSn npn+2,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出W元素的元素符号和该原子基态的电子排布式:__ _____
(2)写出Z元素的原子结构示意图和该原子基态的电子排布图: _ _____
(3)X单质和Z单质在一定条件下反应生成化合物E,则E的电子式是: 。E可以进行喷泉实验的主要原因是: 。
(4)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为___________ __________________
(5)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序)为(写名称) ,该化合物的浓溶液与足量NaOH热浓溶液反应的离子方程式为:____________ __ __
某混合物的水溶液中,可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Al3+、Cl-、CO32-和SO42-。现每次取100.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。
请回答:
(1)c(CO32-)=______________。
(2)用离子方程式表示该溶液呈碱性的原因:____________________________________。
(3)K+是否存在?_____,(填“是”或“否”)若存在,浓度范围是______________________ (若不存在,则不必回答第(2)问)。
(4)根据以上实验,不能判断哪种离子是否存在?若存在,这种离子如何进行检验?
____________________________________________________________________。
某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
请回答下列问题。
(1)图中涉及分离溶液与沉淀的方法是__________________。
(2)B、C、D、E 4种物质的化学式为:B_________、C_________、D_________、E_________。
(3)沉淀F与NaOH溶液反应的离子方程式为__________________________________。
沉淀E与稀硫酸反应的离子方程式为__________________________________________。
溶液G与过量稀氨水反应的化学方程式为______________________________________。
在盛有AgNO3、HCl、Na2CO3、CaCl2、NaI五种无色溶液的试剂瓶上,分别贴有①~⑤的编号。将它们两两混合,产生的现象如右表所列(其中“↑”表示产生气体,“↓”表示生成沉淀,“—”表示无现象):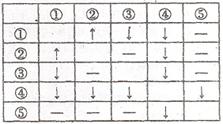
(1)写出③、④、⑤三种物质的化学式为: ③ 、④ 、⑤ 。
(2)写出下列反应的离子方程式:①+② 。
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子L层电子数是K层电子数的2倍 |
| Y |
Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z |
Z存在质量数为23,中子数为12的核素 |
| W |
W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)X的电负性比Y的______(填“大”或“小”);
(2)写出W的价电子排布式 写出Z2Y2与XY2反应的化学方程式, 当1摩尔Z2Y2参加反应时,转移电子的数目:______________。
(3)X、Y的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子在水溶液中反应的离子方程式:______________。
(4)X元素的氢化物的沸点与同主族下一周期的元素的氢化物的沸点比较,沸点高的是 (写化学式)
有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程图生产的。流程图中:A和M(C3H4O)都可发生银镜反应,M和N的分子中碳原子数相同,A的烃基上的一氯代物有3种。
(1)写出下述物质的结构简式:A____________________,M___________。
(2)物质A的同类别的同分异构体的结构简式为________________________。
(3)N+B―→D的化学方程式为_________
(4)反应类型:X为________,Y为_____。
(5)N在一定条件下可以与水反应生成H,H中没有甲基。H也可以生成高分子化合物,写出生成该高分子化合物的化学方程式
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC 为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E是原子核外电子排布未成对电子数最多的元素,ECl
为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E是原子核外电子排布未成对电子数最多的元素,ECl 能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:
能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:
(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的氢化物中一种组成为A2H2分子,此分子A中原子轨道的杂化类型为 ,1 mol A2H2含σ键的数目为 。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)B、C的氢化物的沸点比A的氢化物的沸点高,其主要原因是
(5)E的价电子排布式是 ,ECl3形成的配合物的化学式为
(6)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1∶1。
请回答:
(1)组成A分子的原子的核外电子排布图是 ;
(2)B和C的分子式分别是 和 ;C分子的空间构型为 形,该分子属于 分子(填“极性”或“非极性”);
(3)向D的稀溶液中加入少量氯化铁溶液现象是 ,该反应的化学方程式为 ;
(4)若将1 mol E在氧气中完全燃烧,只生成1 mol CO2和2 mol H2O,则E的分子式是 。
A、B、C、D、E、F为原子序数依次增大的短周期主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层少4个;E元素原子次外层电子数比最外层多3个。
(1)写出下列元素的符号:A , E 。
(2)A、C两种元素的最高价氧化物的水化物反应的离子方程式是 。
(3)A元素的最高价氧化物的水化物与C元素的最高价氧化物反应的化学方程式是 。
(4)与F元素处于同一主族的第四周期元素的基态原子核外电子排布式为 。
(5)用电子式表示B和F形成化合物的过程________________
由环己烷可制得1, 4 – 环己二醇,下列有7步反应(其中无机产物都已略去),其中有2步属于取代反应,2步属于消去反应,3步属于加成反应。试回答: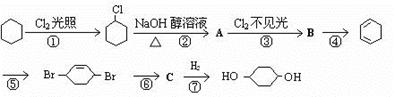
(1) 反应 属于取代反应。
(2) 化合物的结构简式:B ,C ;
(3) 反应④所用试剂和条件是 ;
(4) 写出反应②、⑤的化学方程式:
反应②
反应⑤
2-甲基-2-丁烯酸甲酯是一种重要的化工原料。下面是该物质的一种合成路线: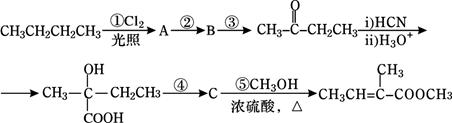
已知:R-CN 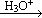 R-COOH。
R-COOH。
请回答下列问题:
(1)A是一氯代烷,则其结构简式为______________________;反应②的反应条件是_____________;
(2)写出反应③的化学方程式:____________________________________________;
(3)C的结构简式为______________,其所含官能团的名称是________________;
(4)步骤④的反应条件是_______________,反应类型是______________。
(5)2-甲基-2-丁烯酸甲酯的某种羧酸类链状同分异构体X,分子中含有3个甲基。则X的结构简式为 。
克砂平是治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):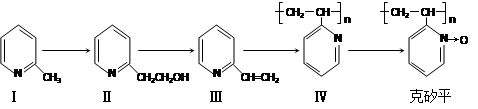
(1)化合物I的分子式为___________,其某些化学性质类似于苯。例如,化合物I可在
一定条件下与氢气发生加成反应生成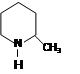 ,其反应方程式(不要求标出反应条件)
,其反应方程式(不要求标出反应条件)
为: _______________________________________。
(2)化合物I生成化合物II是原子利用率为100%的反应,所需另一反应物的分子式为: 。
(3)下列关于化合物II和化合物III的化学性质,说法正确的是 (填字母)
| A.化合物II可以与CH3COOH发生酯化反应 |
| B.化合物II不可以与金属Na反应生成氢气 |
| C.化合物II不可以使酸性高锰酸钾溶液褪色 |
| D.化合物III可以使溴的四氯化碳溶液褪色 |
E.化合物III是芳香烃
(4)化合物III生成化合物Ⅳ的反应方程式为(不要求标出反应条件):
。
A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):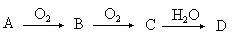
(1)若A是一种金属,C是淡黄色固体,写出C的一种用途 。
(2)若A为淡黄色固体单质,写出D的分子式 。
(3)若A为单质,D为弱酸,则A在工业生产中可用于制备同族另一种非金属单质,该反应的化学方程式为 。
(4)若A是化合物,C是红棕色气体,则A的分子式为 ;C转化为D的过程中,氧化剂与还原剂的质量比为 。
化合物A最早发现于酸奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得。A的该盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行催化氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应: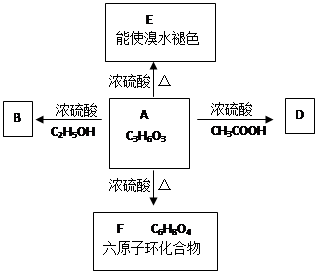
试回答:
(1)写出化合物的结构简式A B D.
(2)写出下列反应的化学方程式:A→E
A→F
(3)写出以下反应的反应类型:A→E ;A→F .
试题篮
()