短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的价电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 。
(2)已知:①E-E→2E·;△H=+a kJ·mol-1
② 2A·→A-A;△H=-b kJ·mol-1
③E·+A·→A-E;△H=-c kJ·mol-1(“·”表示形成共价键所提供的电子)
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 |
甲 |
乙 |
丙 |
| 初始投料 |
2 molA2、1 molBC |
1 molX |
4 molA2、2 molBC |
| 平衡时n(X) |
0.5mol |
n2 |
n3 |
| 反应的能量变化 |
放出Q1kJ |
吸收Q2kJ |
放出Q3kJ |
| 体系的压强 |
P1 |
P2 |
P3 |
| 反应物的转化率 |
α1 |
α2 |
α3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则该时间段内A2的平均反应速率v(A2) 。
②该温度下此反应的平衡常数K的值为 。
③三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
双酚A (也称BPA)常用来生产防碎塑料聚碳酸酯。BPA的结构简式如下图所示。
(1)双酚A中的含氧官能团为______(填名称)。
(2)下列关于双酚A的叙述中,不正确的是______(填标号)。
A.遇FeCl3溶液变色
B.可以发生还原反应
C.1mol双酚A最多可与2molBr2反应
D.可与NaOH溶液反应
(3)双酚A的一种合成路线如下图所示:
①丙烯→A的反应类型是____________。
②B→C的化学方程式是__________________。
③D的结构简式是____________。
(4)双酚A制取聚碳酸酯的过程中需要用到碳酸二甲酯( )。有机物W是碳酸二甲酯的同分异构体,W具有如下特征:
)。有机物W是碳酸二甲酯的同分异构体,W具有如下特征:
i.只含l个甲基
ii.能分别与乙酸、乙醇发生酯化反应
写出W与乙酸反应的化学方程式:________________________。
甲是一种盐,由A、B、C、D、E五种短周期元素元素组成。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如图所示;
④取少量甲溶液于试管中,加入过量NaOH溶液并加热;
回答下列问题:
(1)D在周期表中的位置 写出化合物AB3的电子式
(2)经测定甲晶体的摩尔质量为453 g/mol,其中阳离子和阴离子物质的量之比1:1,且1 mol 甲晶体中含有12 mol结晶水。则甲晶体的化学式为 。
(3)实验③中根据图像得V(0a):V(ab):V(bc)= 。
(4)实验④中离子方程式是 。
某铵态氮肥由W、X、Y、Z等4种短周期元素组成,其中W的原子半径最小。
I.若Y、Z同主族,ZY2是形成酸雨的主要物质之一。
(1)将X、Y、Z的元素符号填在右图所示元素周期表(局部)中的相应位置上。
(2)X的最髙价氧化物对应水化物的稀溶液与铜反应的化学方程式为___ ___。
(3)一定条件下,1mol XW3气体与O2完全反应生成X元素的单质和液态水,放出382.8 kJ热量。该反应的热化学方程式为________________________。
II.若Z是形成化合物种类最多的元素。
(4)该氮肥的名称是______(填一种)。
(5)HR是含Z元素的一元酸。室温时,用0.250mol•L—1NaOH溶液滴定25.0 mL HR溶液时,溶液的pH变化情况如图所示。其中,a点表示两种物质恰好完全反应。
①右图中x______7(填“>”、“<”或“=”)。
②室温时,HR的电离常数Ka=______(填数值)。
某有机物G分子结构的球棍模型如下图所示(图中小球分别表示碳、氢、氧原子,球与球之间的连线“一”不一定是单键)。用芳香烃A为原料合成G的路线如下:
试回答:
(1)G的分子式为_______;G中环状基团被氢原子取代后的有机物名称为_______。
(2)A的结构简式为______;D中官能团的名称为_______。
(3)B→C反应的化学方程式是____________________________;
E→F反应的化学方程式是____________________________。
(4)E的同分异构体中可用通式 表示(其中X、Y均不为H),且能发生银镜反应的物质有_______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可) ________________。
表示(其中X、Y均不为H),且能发生银镜反应的物质有_______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可) ________________。
【化学——选修5:有机化学基础】氧氮杂环是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改善脑缺血等性质。下面是某研究小组提出的一种氧氮杂环类化合物H的合成路线:
(1)原料A的同分异构体中,含有苯环,且核磁共振氢谱中有4个峰的是 (写出其结构简式)。
(2)原料D的结构简式是____________。
(3)反应②的化学方程式是 。
(4)原料B俗名“马来酐”,它是马来酸(顺丁烯二酸: )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( )和聚合物Q:
)和聚合物Q:
①半方酸是原料B的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含-O-O-键。半方酸的结构简式是____________。
②反应I的反应类型是________。
反应II的化学方程式为 。
③两分子苹果酸之间能发生酯化反应,生成六元环酯,请写出该反应的方程式 。
I.物质A为生活中常见的有机物,只含有C、H、O三种元素,已知该有机物的蒸气密度是相同条件下H2密度的23倍,其中氧元素的质量分数为34.8%,且有如下的转化关系:
(1)由A→B的反应类型是 。
(2)D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键,反应①中D与HCl按物质的量之比1:l反应,原子利用率为100%,则D的结构简式是 。
II.化合物E和F是药品普鲁卡因合成的重要原料。普鲁卡因的合成路线如下:
(3)由甲苯生成物质甲的化学方程式为 。
(4)丁的结构简式为 。
(5)反应③的化学方程式是 。
(6)普鲁卡因有两种水解产物戊和己,且戊与甲具有相同的分子式。符合下列条件的戊的同分异构体有 种(包含戊)。
a.分子结构中含苯环,且每个苯环有2个侧链
b.分子结构.中一定含官能团—NH2,且—NH2直接与碳原子相连
戊经聚合反应可制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是 。
物质A、B、C、D、E、F、G、H、I、J有如图所示的转化关系。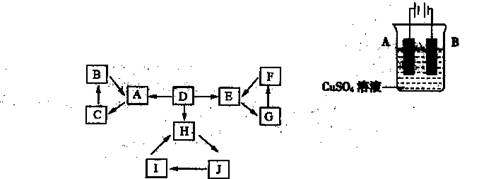
图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素。其它信息见下表:
| 编号 |
信 息 |
| 1 |
D为地壳中含量最高的元素组成的单质 |
| 2 |
E为酸性气态氧化物 |
| 3 |
F的浓溶液常做干燥剂 |
| 4 |
H为淡黄色固体化合物 |
| 5 |
电解饱和J溶液是工业重要反应 |
| 6 |
C为离子化合物,阴、阳离子均含有金属元素 |
(1)写出G的化学式: ,指出H中化学键的类型: 。
(2)常温下测得一定浓度的C溶液的pH=10,用离子方程式表示其原因 。
(3)写出与H相对分子质量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的化学式 。
(4)写出C溶液中通入过量CO2的化学方程式: 。 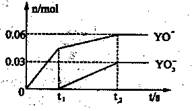
(5)通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中三种含Y元素的离子,其中两种离子物质的量(n)与反应时间(t)的变化示意图如上图所示,写出该反应的离子方程式是 ,该苛性钾溶液中KOH的质量是 g。
用作软质隐形眼镜材料的聚合物E是:
一种合成聚合物E的路线如下:
回答下列问题:
(1)A能与新制Cu(OH)2悬浊液反应产生砖红色沉淀,A的结构简式是 ;
(2)D中含有的官能团名称为 ;
(3)D→E的反应类型是 反应;
(4)C有多种同分异构体。属于酯且含有碳碳双键的同分异构体共有 种(不考虑顺反异构),写出其中核磁共振氢谱峰面积之比为1:1:1:3的同分异构体的结构简式 ;
(5)写出由乙烯合成乙二醇的化学方程式。 。
某蓝色荧光材料F的合成路线如下:
(1)化合物B中含有的含氧官能团的名称是 。
(2)写出化合物CH3NCS的结构式: 。
(3)合成路线中属于加成反应的反应有 。(填序号)
(4)反应③另一产物为甲醇,其化学方程式为 。
(5)与A具有相同的含氮六元环和官能团的同分异构体共有 种(包含本身。已知含氮六元环与苯环结构相似)。
(6)已知: 。请写出以
。请写出以 和甲醇为主要原料制备
和甲醇为主要原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH  CH2=CH2
CH2=CH2 BrCH2—CH2Br
BrCH2—CH2Br
已知:在一定条件下,有如下反应可以发生
某一试剂瓶的标签严重破损,只能隐约看到下列一部分:
取该试剂瓶中的试剂,通过燃烧实验测得:16.6g该物质完全燃烧得到39.6gCO2与9gH2O。进一步实验可知:①该物质能与碳酸氢钠溶液反应生成无色无味气体。②16.6g该物质与足量金属钠反应可生成氢气2.24L(已折算成标准状况)。请回答:
(1)该有机物的分子式 ______。该有机物的结构可能______种。
(2)若下列转化中的D是上述有机物可能结构中的一种,且可发生消去反应;E含两个六元环;F是高分子化合物;取C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液,出现白色沉淀。
①A的结构简式为____________;
②写出A转化成B的化学方程式____________
③写出由D制取F的化学方程式____________。
④反应类型:D→ E____________
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
Ⅰ.原子半径:A < C < B < E< D
Ⅱ.原子的最外层电子数:A = D C= E A + B = C
Ⅲ.原子的核外电子层数:B =" C" = 2A
Ⅳ.B元素的主要化合价:最高正价 + 最低负价 = 2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式 ;
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式: 。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。单质F发生 (填电化学腐蚀类型)
(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为 ,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为 。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2。则该复
盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象
。
以 HCHO 和 C2H2为有机原料,经过下列反应可得化合物 N ( C4H8O2)。
(1)反应Ⅰ的反应类型为 。
(2)HOCH2C≡CCH2OH 分子中,在同一个平面的原子最多有 个。
(3)化合物 M 不可能发生的反应是 (填序号)。
| A.氧化反应 | B.取代反应 | C.消去反应 | D.加成反应 E.还原反应 |
(4)N 的同分异构体中,属于酯类的有 种。
(5)A 与 M 互为同分异构体,有如下转化关系。其中E的结构简式为

填写下列空白:
① A 的结构简式为 ,B 中的官能团名称是 。
② D 的分子式为 。
③ 写出 B 与银氨溶液反应的化学方程式:_ 。
(12分)A~K有如下转化关系,其中K在工业上可用做香味剂.
已知:①A与HCl反应可同时得到B和C两种产物
②E可发生银镜反应,而H不能发生银镜反应
③K的分子式为C6H10O3
④ (R为烃基)
(R为烃基)
⑤ 结构不稳定。
结构不稳定。
请回答下列问题:
(1)写出下列物质的结构简式:A K 。
(2)下列各组物质互为同分异构体的有______ (填选项字母)。
a.B和C
b.D和G
c.E和H
d.F和J
e.A和K
(3)写出下列反应的化学方程式:反应② ,E与新制Cu(OH)2反应 。
(4)H的某种链状同分异构体L的分子中含有两种官能团,L能发生加聚反应生成一种吸水性高分子。L的结构简式为 。
有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属。A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族。下图中均含D或F元素的物质均会有图示转化关系: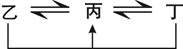
①均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;
②均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题:
(1)化合物甲的电子式为 。
(2)F元素在周期表中的位置 ;稳定性:A2C A2E(填“大于”“小于” “等于”)。
(3)均含有D元素的乙与丁在溶液中发生反应的离子方程式 。
(4)丙、丁分别是含F元素的简单阳离子,检验含丙、丁两种离子的混合溶液中的低价离子,可以用酸性KMnO4溶液,其对应的离子方程式为:
(5)已知常温下化合物FE的Ksp=6×10-18 mol2·L-2,常温下将1.0×10-5mol·L-1的Na2E溶液与含FSO4溶液按体积比3 :2混合,若有沉淀F E生成,则所需的FSO4的浓度要求 。(忽略混合后溶液的体积变化)。
试题篮
()