化学与生活密切相关。下列叙述错误的是( )
A. 高纯硅可用于制作光感电池 B. 铝合金大量用于高铁建设
C. 活性炭具有除异味和杀菌作用 D. 碘酒可用于皮肤外用消毒
【选修五:有机化学基础】
环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:

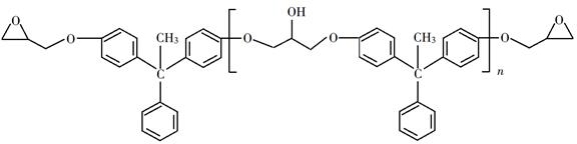
已知以下信息:

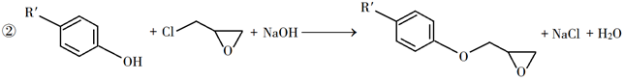
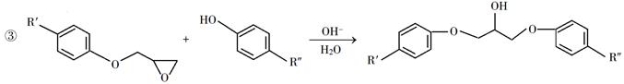
回答下列问题:
(1)A是一种烯烃,化学名称为________,C中官能团的名称为________、________。
(2)由B生成C的反应类型为________。
(3)由C生成D的反应方程式为________。
(4)E的结构简式为________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式________、________。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H 2O的总质量为765g,则G的 n值理论上应等于________。
【选修三:物质结构与性质】
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为________,其沸点比NH 3的________(填"高"或"低"),其判断理由是________。
(2)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f 66s 2 , Sm 3+的价层电子排布式为________。
(3)比较离子半径:F −________O 2−(填"大于"等于"或"小于")。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
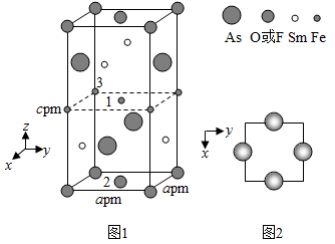
图中F −和O 2−共同占据晶胞的上下底面位置,若两者的比例依次用 x和1− x代表,则该化合物的化学式表示为________,通过测定密度 ρ和晶胞参数,可以计算该物质的 x值,完成它们关系表达式: ρ=________g·cm −3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( , , ),则原子2和3的坐标分别为________、________。
咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5℃,100℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(K a约为10 −4, 易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如下图所示。
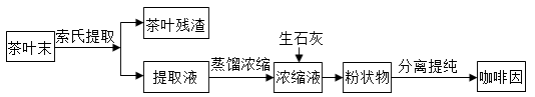
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:
(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒________。
(2)提取过程不可选用明火直接加热,原因是________,与常规的萃取相比,采用索氏提取器的优点是________。
(3)提取液需经"蒸馏浓缩"除去大部分溶剂,与水相比,乙醇作为萃取剂的优点是________。"蒸发浓缩"需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有________(填标号)。
A.直形冷凝管 B.球形冷凝管C.接收瓶D.烧杯
(4)浓缩液加生石灰的作用是________ 和吸收________
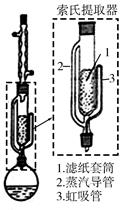
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是________。
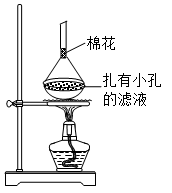
环戊二烯(  )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: 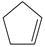 (g) =
(g) = 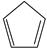 (g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
(g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
H 2(g)+ I 2(g) =2HI(g) Δ H 2=−11.0 kJ·mol −1 ②
对于反应:  (g)+ I 2(g) =
(g)+ I 2(g) = 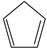 (g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯( 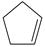 )在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
)在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
| A. |
通入惰性气体 |
B. |
提高温度 |
| C. |
增加环戊烯浓度 |
D. |
增加碘浓度 |
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
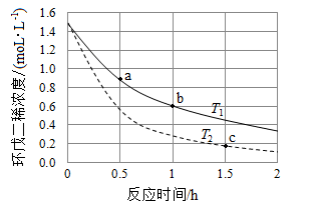
| A. |
T 1> T 2 |
| B. |
a点的反应速率小于c点的反应速率 |
| C. |
a点的正反应速率大于b点的逆反应速率 |
| D. |
b点时二聚体的浓度为0.45 mol·L −1 |
(4)环戊二烯可用于制备二茂铁(Fe(C 5H 5) 2结构简式为  ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
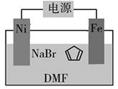

该电解池的阳极为________,总反应为________。电解制备需要在无水条件下进行,原因为________。
立德粉
(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
| A. |
黄色 |
| B. |
红色 |
| C. |
紫色 |
| D. |
绿色 |
(2)以重晶石( )为原料,可按如下工艺生产立德粉:
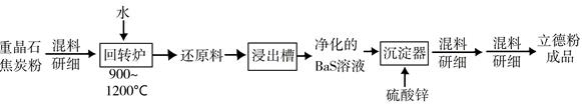
①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为________。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为 和一种清洁能源气体,该反应的化学方程式为________。
②在潮湿空气中长期放置的"还原料",会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是"还原料"表面生成了难溶于水的________(填化学式)。
③沉淀器中反应的离子方程式为________。
(3)成品中 的含量可以用"碘量法"测得。称取 样品,置于碘量瓶中,移取 l的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应 ,有单质硫析出。以淀粉溶液为指示剂,过量的 用 溶液滴定,反应式为 。测定时消耗 溶液体积 。终点颜色变化为________,样品中 的含量为________(写出表达式)。
分子式为
的有机物共有(不含立体异构)( )
| A. |
8种 |
B. |
10种 |
C. |
12种 |
D. |
14种 |
绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )

| A. |
图中a和b分别为 、 温度下CdS在水中的溶解度 |
| B. |
图中各点对应的 的关系为: |
| C. |
向m点的溶液中加入少量 固体,溶液组成由m沿mpn线向p方向移动 |
| D. |
温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动 |
下列化学方程式中,不能正确表达反应颜色变化的是( )
| A. |
向 溶液中加入足量Zn粉,溶液蓝色消失: |
| B. |
澄清的石灰水久置后出现白色固体: |
| C. |
在空气中放置后由淡黄色变为白色: |
| D. |
向 悬浊液中滴加足量 溶液出现红褐色沉淀: |
下列实验现象与实验操作不相匹配的是( )
|
实验操作 |
实验现象 |
|
|
A |
向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 |
溶液的紫色逐渐褪去,静置后溶液分层 |
|
B |
将镁条点燃后迅速伸入集满 的集气瓶 |
集气瓶中产生浓烟并有黑色颗粒产生 |
|
C |
向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 |
有刺激性气味气体产生,溶液变浑浊 |
|
D |
向盛有 溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 |
黄色逐渐消失,加KSCN后溶液颜色不变 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
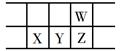
| A. |
原子半径:W<X |
B. |
常温常压下,Y单质为固态 |
| C. |
气态氢化物热稳定性:Z<W |
D. |
X的最高价氧化物的水化物是强碱 |
已知
是阿伏加德罗常数的值,下列说法错误的是( )
| A. |
含有的中子数为 |
| B. |
磷酸钠溶液含有的 数目为 |
| C. |
被还原为 转移的电子数为 |
| D. |
48g正丁烷和10g异丁烷的混合物中共价键数目为 |
"春蚕到死丝方尽,蜡炬成灰泪始干"是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是( )
| A. |
蚕丝的主要成分是蛋白质 |
B. |
蚕丝属于天然高分子材料 |
| C. |
"蜡炬成灰"过程中发生了氧化反应 |
D. |
古代的蜡是高级脂肪酸酯,属于高分子聚合物 |
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
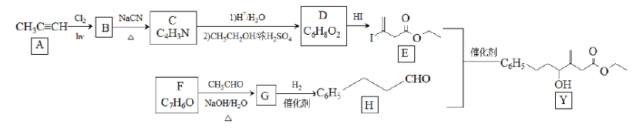
已知: 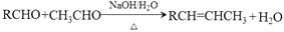
回答下列问题:
(1)A的化学名称是________。
(2)B为单氯代烃,由B生成C的化学方程式为________。
(3)由A生成B、G生成H的反应类型分别是________、________。
(4)D的结构简式为________。
(5)Y中含氧官能团的名称为________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________。
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能 ________ (填"大于"或"小于")。原因是________。
(3) 具有较高的熔点(872 ℃),其化学键类型是________; 不溶于有机溶剂而 、 、 能够溶于乙醇、乙醚等有机溶剂,原因是________。
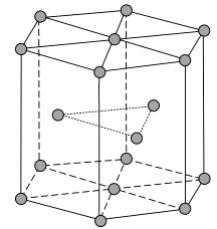
(4)《中华本草》等中医典籍中,记载了炉甘石( )入药,可用于治疗皮肤炎症或表面创伤。 中,阴离子空间构型为________,C原子的杂化形式为________。 (5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为________。六棱柱底边边长为 acm,高为 ccm,阿伏加德罗常数的值为 , Zn的密度为________ (列出计算式)。
试题篮
()