下列实验过程可以达到实验目的的是( )
|
编号 |
实验目的 |
实验过程 |
|
A |
配制 的溶液 |
称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容 |
|
B |
探究维生素C的还原性 |
向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
|
C |
制取并纯化氢气 |
向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和 溶液 |
|
D |
探究浓度对反应速率的影响 |
向2支盛有5mL不同浓度 溶液的试管中同时加入2mL5% 溶液,观察实验现象 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
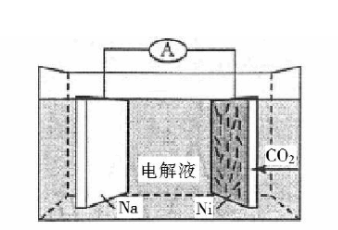
我国科学家研发了一种室温下"可呼吸"的
二次电池,将
溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:
 ,下列说法错误的是()
,下列说法错误的是()
| A. |
放电时, 向负极移动 |
B. |
充电时释放 ,放电时吸收 |
| C. |
放电时,正极反应为: |
D. |
充电时,正极反应为 |
代表阿伏伽德罗常数的值,下列说法正确的是()
| A. |
常温常压下, 中所含P-P键数目为 |
B. |
溶液中所含 的数目为 |
| C. |
标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为 |
D. |
密闭容器中, 和 催化反应后分子总数为 |
W、X、Y和Z为原子序数一次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同,下列叙述正确的是()
| A. |
X与其他三种元素均可形成两种或两种以上的二元化合物 |
B. |
Y与其他三种元素分别形成的化合物中只含有离子键 |
| C. |
四种元素的简单离子具有相同的电子层结构 |
D. |
W的氧化物对应的水化物均为强酸 |
实验室用如图所示的装置进行甲烷与氯气在光照下反应的实验。
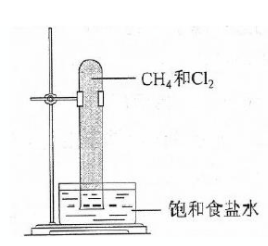
光照下反应一段时间后,下列装置示意图中能正确反应实验现象的是()
| A. |
|
B. |
|
C. |
|
D. |
|
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是()

| A. |
雾和霾的分散剂相同 |
B. |
雾霾中含有硝酸铵和硫酸铵 |
| C. |
是形成无机颗粒物的催化剂 |
D. |
雾霾的形成与过度施用氮肥有关 |
化学与生活密切相关,下列说法错误的是()
| A. |
碳酸钠可用于去除餐具的油污 |
B. |
漂白粉可用于生活用水的消毒 |
| C. |
氢氧化铝可用于中和过多的胃酸 |
D. |
碳酸钡可用于胃肠X射线造影检查 |
化合物W可用作高分子膨胀剂,一种合成路线如下:

回答下列问题
(1)A的化学名称为________。
(2)②的反应类型是________。
(3)反应④所需试剂,条件分别为________。
(4)G的分子式为________。
(5)W中含氧官能团的名称是________。
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,
峰面积比为1:1)________。
(7)苯乙酸苄酯( 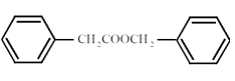 )是花香类香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线________(无机试剂任选)。
)是花香类香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线________(无机试剂任选)。
Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻,能量密度大等优良性能,得到广泛应用,回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________。(填标号)
| A. |
|
| B. |
|
| C. |
|
| D. |
|
(2) 与 具有相同的电子构型, 小于 ,原因是________。
(3) 是有机合成中常用的还原剂, 中的阴离子空间构型是________。中心原子的杂化形式为________, 中,存在________(填标号)。
| A. |
离子键 |
| B. |
σ键 |
| C. |
π键 |
| D. |
氢键 |
(4) 是离子晶体,其晶格能可通过图(a)的 Born-Haber循环计算得到

可知,Li原子的第一电离能为________ , O=O键键能为________ , 晶格能为________
(5) 具有反莹石结构,晶胞如图(b)所示。已知晶胞参数为0.4665mm,阿伏加德罗常数的值为 ,则 的密度为 ________ (列出计算式)。
采用 为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用,回答下列问题:
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到 , 该反应的氧化产物是一种气体,其分子式为________。
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时 (g)分解反应:
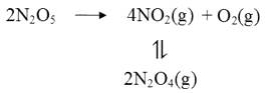
其中 二聚为 的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=x时, (g)完全分解):
|
t/min |
0 |
40 |
80 |
160 |
260 |
1300 |
1700 |
∞ |
|
P/kPa |
35.8 |
40.3 |
42.5 |
45.9 |
49.2 |
61.2 |
62.3 |
63.1 |
①已知:
则反应 的△H=________
②研究表明, (g)分解的反应速率 ,t=62min时,测得体系中 ,则此时的 =________ kPa,V=________ kPa, 。
③若提高反应温度至35℃,则 完全分解后体系压强 (35℃)________63.1kPa(填"大于""等于"或"小于"),原因是________。
④25℃时 反应的平衡常数 ________ kPa ( 为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应 ,R,A,Ogg提出如下反应历程:
第一步 快速平衡
第二步 慢反应
第三步 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是 __________(填标号)。
| A. |
ν(第一步的逆反应P>ν(第二步反应) |
| B. |
反应的中间产物只有 |
| C. |
第二步中 与 的碰撞仅部分有效 |
| D. |
第三步反应活化能较高。 |
醋酸亚铬[ ]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂,一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是________,仪器a的名称是________。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开 , ,关闭 。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为________。
②同时c中有气体产生,该气体的作用是________。
(3)打开 ,关闭 和 。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是________、________、洗涤、干燥。
(4)指出装置d可能存在的缺点________。
最近我国科学家设计了一种,CO₂+H₂S协同转化装置,实现对天然气中CO₂和H₂S的高效去除。示意图如右所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
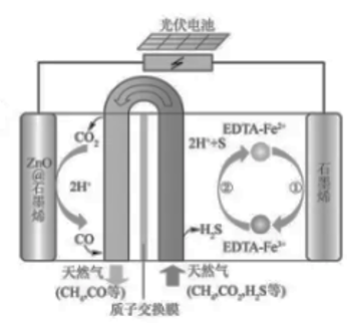
①E
②
该装置工作时,下列叙述错误的是( )
| A. |
阴极的电极反应: |
B. |
协同转化总反应:CO₂+H₂S=CO+H₂O+S |
| C. |
石墨烯上的电势比ZnO@石墨烯上的低 |
D. |
若采用 取代 , 溶液需为酸性 |
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20,W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是( )
| A. |
常温常压下X的单质为气态 |
B. |
Z的氢化物为离子化合物 |
| C. |
Y和Z形成的化合物的水溶液呈碱性 |
D. |
W与Y具有相同的最高化合价 |
环之间共用一个碳原子的化合物称为螺环化合物,螺[22]戊烷(  )是最简单的一种,下列关于该化合物的说法错误的是( )
)是最简单的一种,下列关于该化合物的说法错误的是( )
| A. |
与环戊烯互为同分异构体 |
B. |
二氯代物超过两种 |
| C. |
所有碳原子均处同一平面 |
D. |
生成 至少需要 |
试题篮
()