已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB- H++B2- ,则下列说法中一定正确的是
H++B2- ,则下列说法中一定正确的是
A、在Na2B溶液中一定有:c(OH )=c(H
)=c(H )+c(HB
)+c(HB )+2c(H2B)
)+2c(H2B)
B、NaHB溶液可能存在以下关系:c(Na )>c(HB
)>c(HB )>c(OH
)>c(OH )>c(H
)>c(H )
)
C、NaHB水溶液中一定有:c(Na )+c(H
)+c(H )=c(HB
)=c(HB )+c(OH
)+c(OH )+c(B
)+c(B )
)
D、NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)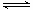 N2O4 (g) ΔH=-a kJ/mol (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)="0.6" mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是
N2O4 (g) ΔH=-a kJ/mol (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)="0.6" mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是
A. > >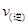 |
B. < <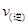 |
C. = =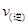 |
D. 、 、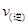 大小关系不确定 大小关系不确定 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
W |
| 原子半径/pm |
160 |
143 |
70 |
66 |
| 主要化合价 |
+2 |
+3 |
+3、+5、-3 |
-2 |
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z从其氢化物中置换出来
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法错误的是
| A.电池工作时,锌失去电子,电解液内部OH-向负极移动 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
下列有关问题,与盐的水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
| A.②③④ | B.①②③④⑤ | C.①④⑤ | D.①②③ |
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
| A.化合物YX、ZX2、WX3都是酸性氧化物 |
| B.元素W 的最高价氧化物对应水化物的酸性比Z 的弱 |
| C.原子半径的大小顺序: rY >rZ >rW >rX |
| D.元素X 的简单气态氢化物的热稳定性比W 的弱 |
一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2 符合上述转化关系的A、C可能是
①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2
A.只有②③④⑥ B.除①外 C.除⑤外 D.全部
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是
| A.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 |
| B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 |
| C.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
已知:2H2(g)+O2(g)=2H2O(l)ΔH=-571.6kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)ΔH=-1452kJ·mol-1
H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ·mol-1
下列说法正确的是
| A.H2(g)的燃烧热ΔH=-571.6 kJ·mol-1 |
| B.H2SO4(aq)+Ba(OH)2(aq)= BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1 |
| C.同质量的H2(g)和CH3OH(l)完全燃烧生成液态水,H2(g)放出的热量多 |
| D.3H2(g)+CO2(g)= CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1 |
能正确表示下列反应的离子方程式是
| A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O |
| B.NaHSO3溶液中通入少量Cl2:HSO3- + Cl2+ H2O=3H+ +SO42- +2Cl- |
C.氯化钠与浓硫酸混合加热:H2SO4+2Cl- SO2↑+Cl2↑+H2O SO2↑+Cl2↑+H2O |
| D.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O |
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾,撞击时发生反应的化学方程式为:5KClO3+6P=3P2O5+5KCl,则下列有关叙述错误的是
| A.上述反应是放热反应 |
| B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾) |
| C.上述反应中消耗3molP时,转移电子的物质的量为15mol |
| D.该反应氧化剂与还原剂物质的量之比为6:5 |
NA为阿伏加德罗常数的值,下列说法正确的是
| A.18gD2O和18gH2O中含有的质子数均为10NA |
| B.2L0.5mol/L亚硫酸溶液中含有的氢离子数为2NA |
| C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
| D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
试题篮
()