某氯碱工厂用电解饱和食盐水制取烧碱,原理为:2H2O+2NaCl 2NaOH+H2↑+Cl2↑,另将生成的H2与Cl2恰好完全化合生成HCl制取浓盐酸。现将22.1t饱和食盐水电解完全(忽略水的挥发和气体的溶解),共收集到H2为0.1t。试计算:
2NaOH+H2↑+Cl2↑,另将生成的H2与Cl2恰好完全化合生成HCl制取浓盐酸。现将22.1t饱和食盐水电解完全(忽略水的挥发和气体的溶解),共收集到H2为0.1t。试计算:
(1)NaOH中质量分数最大的元素为 。
(2)电解后所得烧碱溶液的溶质质量分数(结果精确到0.1%)。
(3)制得溶质质量分数为36.5%浓盐酸的质量。
早在春秋战国时期,我国就开始生产和使用铁器。某实验小组利用焦炭和Fe 2O 3模拟早期炼铁并检验可能的产物,实验装置如图:
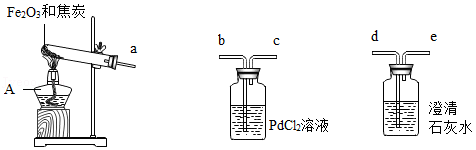
【查阅资料】①铁粉为黑色;常温下,Fe、Fe 3O 4可被磁铁吸引;
②PbCl 2溶液可用于检验CO,原理是:PdCl 2+CO+H 2O═Pd↓+CO 2+2HCl;
③Fe 3O 4与硫酸反应:Fe 3O 4+4H 2SO 4═FeSO 4+Fe 2(SO 4) 3+4H 2O。
【实验现象】澄清石灰水变浑浊,PdCl 2溶液中产生黑色沉淀,玻璃管内粉末全部变成黑色。冷却后,用磁铁靠近黑色固体,黑色固体被部分吸引。
(1)仪器A的名称是 。
(2)为了检验气体产物,装置从左到右的接口连接顺序为a→ → →
→ 。
(3)澄清石灰水变浑浊的化学方程式为 。
【实验结论】反应生成CO和CO 2,磁铁上的黑色固体可能是Fe、Fe 3O 4。
【提出猜想】磁铁上的黑色固体是什么?
猜想一:Fe
猜想二:Fe 3O 4
猜想三:Fe和Fe 3O 4
【设计实验】
| 设计思路 |
操作 |
现象 |
结论 |
| 定性实验 |
取少量黑色固体于试管中,加入足量稀硫酸,充分反应 |
固体完全溶解,产生气泡 |
猜想 成立 |
| 定量实验 |
取一定质量的稀硫酸(足量)放入烧杯中,加入5.6g黑色固体,充分反应后称量溶液的质量 |
固体完全溶解,产生气泡,溶液增加的质量为 g。 |
猜想一成立 |
【归纳总结】根据实验结论和探究结果C与Fe 2O 3反应的化学方程式为 。
重庆多地曾出现过盐井,从天然盐井中获取粗盐(含泥沙、CaCl2、MgCl2、Na2SO4等杂质)。为了除去以上杂质得到精盐,小明设计如下实验:
【提示】杂质含量较少,不考虑微溶物形成沉淀。
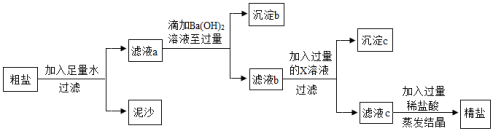
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 。
(2)沉淀b所含物质为Mg(OH)2和 。
(3)物质X是 。
(4)滤液c中加入稀盐酸后发生中和反应的化学方程式为 。
(5)为了证明滴加的Ba(OH)2溶液已过量,取少许上层清液于试管中加入一种试剂即可。下列物质的溶液能达到实验目的有 。
A.Ba(OH)2
B.K2CO3
C.Na2SO4
D.KCl
识别图像是学习化学的必备能力。下列图像能正确反映实验设计的是( )
| 序号 |
① |
② |
③ |
④ |
| 图像 |
|
|
|
|
| 实验设计 |
电解一段时间(忽略气体的溶解) |
分别向相同的CuSO 4溶液(足量)中加入质量相等的锌粉和铁粉 |
向稀盐酸中滴加NaOH溶液 |
分别向等质量大理石中滴加相同的稀盐酸(足量) |
| A. |
①② |
B. |
①④ |
C. |
②③ |
D. |
③④ |
二氧化氯(ClO 2)常用于自来水消毒,工业制取原理为:2NaClO 3+4HCl(浓)═2ClO 2↑+2NaCl+Cl 2↑+2H 2O。某工厂将30kg NaClO 3固体加到100kg浓盐酸中,反应一段时间后,生成13.5kg ClO 2(生成的气体全部逸出,其它物质全部形成溶液)。
已知:NaClO 3和ClO 2的相对分子质量分别为106.5和67.5。
试计算:
(1)NaClO 3中钠元素和氧元素的质量比为 。
(2)参加反应的NaClO 3的质量。
(3)所得溶液中NaClO 3的质量分数(计算结果精确到1%)
某兴趣小组查阅资料发现除去泥沙等杂质的粗盐,可能还含有CaCl2、MgCl2、Na2SO4等杂质。他们将该粗盐配成溶液,并对粗盐溶液进行探究和除杂。
(1)配制溶液时,加速粗盐溶解的玻璃仪器是 。
【探究过程】
(2)步骤1:向粗盐溶液中加入过量NaOH溶液,未出现明显现象,说明溶液中无
杂质;向溶液中继续滴加过量Na2CO3溶液,产生白色沉淀CaCO3固体。反应的化学方程式为 。
(3)步骤2:向步骤1的滤液中滴加过量BaCl2溶液,产生白色沉淀,过滤;向滤液中滴加稀盐酸至溶液呈中性即得NaCl溶液。加稀盐酸除去的物质是 。
【初步结论】杂质成分已确定,且已完全除去。
【反思交流】
(4)小东认为Na2SO4还不能确定是否存在,可向步骤2的沉淀中滴加过量稀盐酸,若观察到 的现象,证明粗盐中确实存在Na2SO4。
(5)小红认为杂质也未完全除去,可按照步骤1和步骤2重新实验,并对调其中两种试剂的位置就能达到除杂目的,这两种试剂为 (填序号)。
A.Na2CO3溶液、BaCl2溶液
B.稀盐酸、BaCl2溶液
C.NaOH溶液、Na2CO3溶液
向盛有硫酸和硫酸铜混合溶液的烧杯中滴入Ba(OH) 2溶液,烧杯中溶质的质量与加入的Ba(OH) 2溶液的质量关系如图所示。下列有关说法正确的是( )
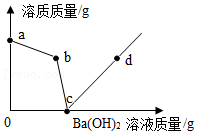
| A. |
a→b段溶液的质量一定减小 |
| B. |
b→c段有水生成 |
| C. |
b点溶液溶质为硫酸铜 |
| D. |
d点沉淀质量与b点沉淀质量相等 |
钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙,现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。

提示①食醋的主要成分是醋酸(HAc)。醋酸和碳酸钙反应的化学方程式为CaCO3+2HAc═CaAc2+H2O+CO2
②鱼骨中其它成分与食醋反应生成的气体可忽略不计
(1)该实验中浓硫酸的作用是 。
(2)由图乙中的AB曲线,可知锥形瓶中反应速率的变化情况是 (选填“变大”、“变小”或“不变)。
(3)根据图中的数据计算鱼骨中碳酸钙的质量分数。
(4)生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明 。
2021年3月,中央财经会议明确把碳达峰、碳中和纳入生态文明建设整体布局,争取在2060年前实现碳中和。“碳中和”是指在一定时间内产生的二氧化碳排放总量,通过二氧化碳去除手段来抵消掉这部分碳排放,达到“净零排放”的目的。
(1)二氧化碳是引起温室效应的主要气体,根据图甲回答支持这一结论的信息是: 。

(2)科学家已经研究出多种方式来实现二氧化碳的转化。
①固碳的另一种方法是将收集的二氧化碳和水混合后注入地下玄武岩中,最终与岩石中的矿物质作用形成固态的石头碳酸盐。这种固碳方式属于 变化(选填“物理”或“化学”)。
②我国研发的“液态太阳燃料合成技术”(图乙),甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。甲醇制取过程中能量转化是:太阳能→电能→ 能。甲醇合成时,若碳元素全部来自于二氧化碳,则制取10吨甲醇需要消耗二氧化碳 吨。
(二氧化碳转化成甲醇的方程式为:CO2+3H2 CH3OH+H2O)
CH3OH+H2O)
取敞口放置的氢氧化钠溶液于烧杯中,倒入一定量的稀硫酸充分反应。为探究反应后所得溶液X的成分,兴趣小组进行了如图实验(所加试剂均足量):
(1)过滤中玻璃棒的作用是 。
(2)产生的无色气体是 。
(3)溶液X的溶质是 。
(4)计算滤液A中氯化钠的质量。

酸碱理论的发展如图:
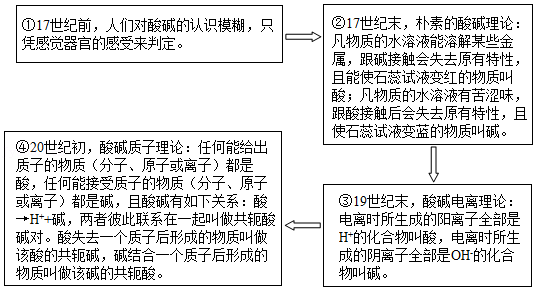
(1)根据朴素的酸碱理论,Na2CO3属于 (选填“酸”或“碱”)。
(2)根据酸碱电离理论理解酸碱反应的实质是: 。
(3)已知H2CO3→HCO3﹣+H+和HCO3﹣→CO32﹣+H+,由酸碱质子理论,H2CO3的共轭碱是 。
(4)随着认知水平的不断提高,人们对酸碱理论的描述也在不断完善。下列对不同酸碱理论的分析合理的是 。
A.酸碱电离理论认为酸碱是两种不同的物质
B.酸碱电离理论认为氧元素是酸中必不可少的元素
C.酸碱质子理论认为酸和碱可以是分子,也可以是离子
D.酸碱质子理论扩大了酸和碱的范围,不再具有局限性
向一定质量的Mg(NO 3) 2和Cu(NO 3) 2混合溶液中加入a克锌粉和铁粉的混合物,充分反应后过滤,得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,得到的固体质量仍为a克。下列分析合理的是( )
①滤渣中可能有铜
②向滤渣中加稀盐酸,可能有气泡产生
③滤液中一定有Mg(NO 3) 2、Zn(NO 3) 2和Fe(NO 3) 2,可能有Cu(NO 3) 2
④若忽略过滤操作中溶液损失,滤液中溶质的质量一定大于原混合溶液溶质的质量
| A. |
①② |
B. |
①③ |
C. |
②③ |
D. |
②④ |
实验室有一瓶敞口放置的氢氧化钠固体样品,为探究样品中的成分,小科进行如下实验:
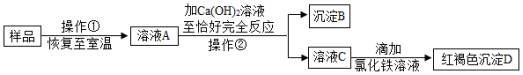
(1)操作①是加水充分溶解,操作②的名称是 。
(2)沉淀B的化学式是 。
(3)小科根据实验现象认为样品中一定含有氢氧化钠,请你评价小科的判断是否正确,并说明理由 。
为测定石灰石样品中碳酸钙含量,某小组同学在一定质量的样品中加入足量稀盐酸,利用生成CO2的质量来测定(忽略稀盐酸挥发的影响)。
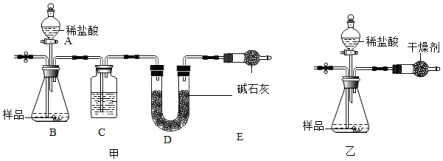
(1)小科用图甲装置实验,通过测定反应前后D装置质量的变化来得到CO2质量。为了避免水蒸气对实验的影响,使测最结果更准确,装置C中应装入 (填试剂名称)。
(2)小明用图乙装置实验,通过测定反应前后装置总质量的变化来得到CO2质量。他用碱石灰做干燥剂,请判断这种做法是否合理并说明理由 。
(3)实验时。正确选择干燥剂后,两装置均可通过左侧导管鼓入某种气体一段时间,来进一步减小误差。下列操作可行的是 。
选项 |
实验装置 |
反应开始前鼓入的气体 |
反应结束后鼓入的气体 |
A |
甲 |
氮气 |
氮气 |
B |
甲 |
干燥空气 |
干燥空气 |
C |
乙 |
氮气 |
氮气 |
D |
乙 |
干燥空气 |
干燥空气 |
小宁用稀盐酸和石灰石反应制取二氧化碳(石灰石中的杂质既不溶于水也不和酸反应),为了探究反应后溶液的成分,他又进行如下实验:取反应后的溶液50g于烧杯中,逐滴滴入碳酸钠溶液,发现先有气泡产生,后生成白色沉淀。下表为产生的气体总质量、沉淀总质量与滴入碳酸钠溶液总质量的关系。
碳酸钠溶液总质量/g |
25.0 |
50.0 |
75.0 |
100.0 |
125.0 |
150.0 |
175.0 |
200.0 |
气体总质量/g |
1.1 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
沉淀总质量/g |
0 |
0 |
2.5 |
5.0 |
m |
n |
9.0 |
9.0 |
(1)表中n= 。
(2)所取的反应后50g溶液中溶质是 。
(3)所用碳酸钠溶液中溶质的质量分数是多少?
试题篮
()