工业纯碱中含少量氯化钠。兴趣小组分别采用不同的方法测定工业纯碱样品中碳酸钠的质量分数。
(1)方法一:差量法。称取W克样品与足量的稀盐酸充分反应,生成的二氧化碳通过装有试剂X的乙装置,并利用测量乙装置增加的质量,求得样品中碳酸钠的质量分数。该方法中试剂X可选用 。
(2)方法二:沉淀法。称取15克样品完全溶解于水中配成60克样品溶液,取三个烧杯分三次进行实验,每次加入30克氯化钙溶液充分反应,过滤、洗涤、干燥所得的沉淀质量记录如表。计算样品中碳酸钠的质量分数。
(Na2CO3+CaCl2═CaCO3↓+2NaCl)
烧杯1 |
烧杯2 |
烧杯3 |
|
样品溶液(克) |
10 |
20 |
30 |
氯化钙溶液(克) |
30 |
30 |
30 |
沉淀质量(克) |
2 |
4 |
5 |
(3)请写出提高方法一测量精确度的操作建议(写出2条) 。

某同学用足量的金属镁与7.3克5%的稀盐酸反应,测量产生氢气的体积。
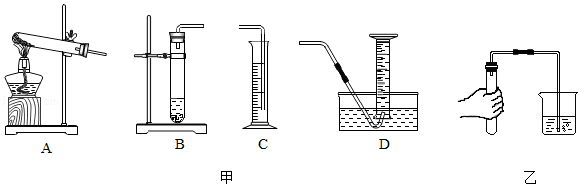
(1)已知氢气的密度比空气小,难溶于水。应选择甲图中的 装置进行制取和收集。
(2)乙图为检查发生装置气密性的操作,当观察到水中的导管口有 产生,则表示该装置气密性良好。
(3)已知氢气的密度为0.09克/升,请计算能收集到多少升氢气。(计算结果精确到0.01)
(4)反应结束后,发现实际收集到的气体体积比计算值要大,请分析可能原因 (写出两点)。
新冠疫情发生以来,在“坚定信心、同舟共济、科学防治、精准施策”的思想指引下,中国抗疫取得重大胜利!
(1)对新型冠状病毒的毒株分离和基因测序,是研发疫苗和药物的基础。为应对疫情,同学们都居家学习,在此期间做法合理的有 。
A.健康饮食,平衡膳食
B.长时间躺床上看书
C.多服用抗生素增强抵抗力
D.关爱家人,乐观面对生活
(2)佩戴口罩出行是预防新冠肺炎的重要举措。一次性口罩需要及时更换,废弃的口罩应放入 垃圾桶最合适。
(3)对公共场所的定期消毒是控制新冠肺炎的有力保障。“84”消毒液被广泛用于新冠疫情的卫生消毒,可通过氯气与氢氧化钠反应制取,生成物中有氯化钠、次氯酸钠(NaClO) 和水,其中次氯酸钠是消毒液的有效成分。
①次氯酸钠中氯元素的化合价为 。
②写出制取“84”消毒液的化学方程式 。

如图所示,是小科建构的铜及其化合物之间相互转化的关系图。
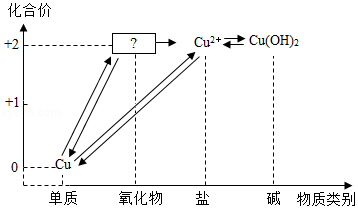
(1)写出图中“?”处物质的化学式 。
(2)要一步实现图中“Cu→Cu2+”的转化,可将铜加入适量的某种盐溶液中,则该溶液的溶质是 。
(3)根据图中的转化关系,利用硝酸铜溶液制备纯净的硫酸铜晶体。请设计一个实验方案,要求写出主要操
作步骤及所需要的试剂 。
某科学兴趣小组同学取8.5g铁,放到含少量硫酸的硫酸铜溶液中,完全反应后,最终得到9.2g固体。为测定所得固体中各成分的含量,同学们将62.5g稀盐酸分五次加入到该固体中,得到数据如表:
次数 |
1 |
2 |
3 |
4 |
5 |
加入盐酸溶液质量/g |
12.5 |
12.5 |
12.5 |
12.5 |
12.5 |
剩余固体质量/g |
8.5 |
7.8 |
a |
6.4 |
6.4 |
请分析计算:
(1)表中a的值是 。
(2)9.2g固体中铁的质量是 。
(3)稀盐酸的溶质质量分数是多少?
(4)与硫酸铜反应的铁的质量是多少?
面粉是制作美食的原材料。在发面团的过程中会生成酸而影响口味,为使食品更美味,可以加碱面处理。碱面的主要成分为碳酸钠(Na2CO3),为测定某品牌碱面中碳酸钠的质量分数,小金按照如图甲所示实验装置,利用碱面与盐酸反应生成二氧化碳气体的质量来计算碱面中碳酸钠的质量分数(杂质不与盐酸反应)。
完成下列问题:
(1)为完成碳酸钠质量分数的测定实验,气体发生装置应选择图乙中的 装置(填字母)。
(2)小金各取11.0克碱面样品与一定量的稀盐酸进行三次实验,三次实验所采集的数据见表。合理选择表中数据并计算碱面中碳酸钠的质量分数;
实验次数 |
碱面样品质量/克 |
稀盐酸质量/克 |
二氧化碳质量/克 |
1 |
11.0 |
50.0 |
1.1 |
2 |
11.0 |
200.0 |
4.4 |
3 |
11.0 |
250.0 |
4.4 |
(3)按照图甲实验装置测定的CO2气体质量,可能导致CO2质量测定结果偏小的原因 (写出一种即可)。
面粉是制作美食的原材料。在发面团的过程中会生成酸而影响口味,为使食品更美味,可以加碱面处理。碱面的主要成分为碳酸钠(Na2CO3),为测定某品牌碱面中碳酸钠的质量分数,小金按照如图甲所示实验装置,利用碱面与盐酸反应生成二氧化碳气体的质量来计算碱面中碳酸钠的质量分数(杂质不与盐酸反应)。
完成下列问题:
(1)为完成碳酸钠质量分数的测定实验,气体发生装置应选择图乙中的 装置(填字母)。
(2)小金各取11.0克碱面样品与一定量的稀盐酸进行三次实验,三次实验所采集的数据见表。合理选择表中数据并计算碱面中碳酸钠的质量分数;
实验次数 |
碱面样品质量/克 |
稀盐酸质量/克 |
二氧化碳质量/克 |
1 |
11.0 |
50.0 |
1.1 |
2 |
11.0 |
200.0 |
4.4 |
3 |
11.0 |
250.0 |
4.4 |
(3)按照图甲实验装置测定的CO2气体质量,可能导致CO2质量测定结果偏小的原因 (写出一种即可)。
"84消毒液"是一种常用含氯消毒用品,有效成分是次氯酸钠(NaClO)。使用时,可根据实际需求进行配比,并规范使用,以防引发危险。
(1)"84消毒液"中的有效氯来自次氯酸钠,计算次氯酸钠中氯元素的质量分数。(计算结果精确到0.1%)
(2)现需要5L有效氯浓度为500mg/L的稀溶液,选用有效氯浓度为50000mg/L的某品牌"84消毒液"进行配制,需加水多少升?( 忽略混合前后溶液体积的变化)
(3)"84消毒液"不能与洁厕灵混合使用,因为"84消毒液"里的次氯酸钠与洁厕灵里的盐酸会发生化学反应,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
| 浓度(mg/m 3) |
对人体的影响 |
| 3000 |
可立即麻痹呼吸中枢,导致瞬间死亡 |
| 120﹣170 |
极为危险,会引起急性肺水肿及肺炎 |
| 40﹣60 |
在1小时内便可致人严重中毒 |
通过计算分析,在10米 3密闭空间里,若将1.49克次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响?(次氯酸钠与盐酸反应的化学方程式为:NaClO+2HCl═NaCl+Cl 2↑+H 2O)
有一包白色粉末,可能含氯化钠、氢氧化钠、碳酸钠中的一种或几种,为了确定其组成,小明称取了9.3克粉末,向其中加入100克7.3%的稀盐酸充分反应,生成的二氧化碳气体完全逸出(忽略其他物质逸出),所得溶液的质量为107.1 克。用pH试纸检测溶液呈中性。
(1)产生二氧化碳气体的化学反应方程式为 。
(2)这包白色粉末的成分为 。
(3)求所得溶液中溶质的质量分数。(写出计算过程,结果保留一位小数)
阅读下列材料,回答问题:
材料一:研究人员发现大气层中特别是南极上空的臭氧层日益变薄。进入大气平流层的氯氟烃(一类合成有机化合物,应用于冰箱和空调的制冷剂、灭火器等)是造成臭氧层变薄的主要原因。因为在紫外线的照射下,平流层中的臭氧存在如下平衡:O 3 O 2+O;而氯氟烃进入平流层后会分解产生氯原子(Cl),进而发生下列反应:Cl+O 3→ClO+O 2;ClO+O→Cl+O 2
研究表明:平流层中1个氯原子大约可以破坏1×10 5个臭氧分子。氯氟烃分解产生的氯原子在上述反应中起着 作用。
为测定某石灰石样品中碳酸钙的质量分数,取25g该样品(杂质不参加反应也不溶于水),加入盛有146g稀盐酸的烧杯中,恰好完全反应,气体全部逸出,反应后烧杯内物质的总质量为162.2g。计算:
(1)生成二氧化碳的质量;
(2)石灰石样品中碳酸钙的质量分数;
(3)反应后所得溶液中溶质的质量分数(结果精确至0.1%)。
为测定某CuSO 4溶液中溶质的质量分数,取150g CuSO 4溶液,平均分为三份,每份样品均按如图所示进行实验,实验数据见表。请计算:
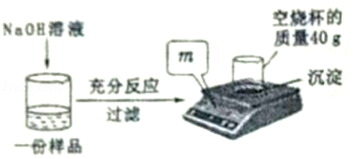
| |
实验1 |
实验2 |
实验3 |
| 样品质量/g |
50 |
50 |
50 |
| NaOH溶液质量/g |
20 |
40 |
60 |
| m/g |
44.9 |
49.8 |
49.8 |
(1)50g CuSO 4溶液完全反应时,所得沉淀的质量为 g。
(2)CuSO 4溶液中溶质的质量分数。
取氯化钡和盐酸的混合溶液100g于烧杯中,向其中滴加碳酸钠溶液,产生气体或沉淀的质量与加入的碳酸钠溶液质量的关系如图所示,请回答:
(1)产生沉淀的质量为 g。
(2)x的值为 。
(3)求所用碳酸钠溶液中溶质的质量分数(请写出计算过程)。

硝酸是一种重要的酸,可用于生产化肥、染料和炸药。工业上利用氮的氧化物、氧气与水反应制备硝酸。
(1)某常见氮的氧化物中N、O两种元素的质量比为7:16,则该化合物的化学式为 。
(2)将该氮的氧化物23.0g与足量的氧气缓慢通入一定量水中(NO x+O 2+H 2O→HNO 3),得到60.0g硝酸溶液溶液的溶质质量分数为多少?(写出计算过程)
试题篮
()