对比实验是运用比较的方法来揭示事物的性质或变化规律的一种实验方法。课本中设计的下列实验不属于对比实验的是
某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品30g放入烧杯中,让后将200g溶质质量分数为19.6%的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应。实验数据如下:
请计算:
(1)该合金中铜的质量分数为 。
(2)该合金除铜外,另一种金属是 。(写出过程)
(3)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数。
鱼塘供氧时常向水中撒一种微黄色的固体过氧化钙(CaO2)。
(1)将该反应方程式补充完整:2CaO2+2H2O=2 + O2↑。
(2)若向水中投入72g CaO2,能生成氧气多少克?
某实验小组设计了右图所示的实验装置。
(1)甲同学认为打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是 。
(2)乙同学认为利用Ⅰ、Ⅲ装置可以测定空气中氧气的含量。关闭K、K1、K2,用凸透镜引燃B中的白磷,待冷却后打开K2,整个实验过程中的现象是 。
(3)丙同学认为可以利用Ⅰ、Ⅲ装置验证二氧化碳的性质。
①若要验证二氧化碳能与水发生反应,应向烧杯的水中加入 ;
②若广口瓶B中盛放二氧化碳,A中盛放氢氧化钠溶液,烧杯中盛放稀盐酸,验证二氧化碳能与氢氧化钠发生反应的操作是 。
某化学活动小组探究金属的反应规律。
【探究一】在室温条件下进行右图所示实验。
已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量和等质量分数的稀硫酸,甲中反应方程式为 。
(1)若比较镁和铁的金属活动性,观察到的现象是 ;
(2)若比较相同时间内镁、铁与稀硫酸反应放出热量的多少,长颈漏斗中的现象是 ;
(3)若实验所用的金属均过量,则甲装置中产生的H2的质量 (填“大于”、“小于”或“等于”)乙装置中产生的H2质量。
【探究二】在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生。下列判断正确的是 。
| A.滤出的固体中一定含有铜 |
| B.滤出的固体可能含有铁和镁 |
| C.滤液中可能含有硫酸铜 |
| D.滤液中一定含有硫酸镁和硫酸亚铁 |
右图是NaOH溶液与稀盐酸恰好完全反应的微观示意图,由此得到的结论不正确的是
| A.反应结束时溶液的pH="7" |
| B.NaOH溶液中存在的粒子是Na+和OH- |
| C.该反应的实质是H+和OH-结合生成H2O分子 |
| D.若两者恰好完全反应,所得溶液中溶质的质量分数为11.7%,则此溶液中钠离子与水分子的个数比为36:883 |

下列有关化学实验的“目的→操作→现象→结论”的描述都正确的是
| 选项 |
目的 |
操作 |
现象 |
结论 |
| A |
比较铝和铜的金属活动性 |
将铝丝浸入硫酸铜溶液中 |
铝丝表面无明显现象 |
铜比铝活泼 |
| B |
检验集气瓶中是否集满二氧化碳 |
将燃着的木条伸入集气瓶中 |
木条火焰熄灭 |
集气瓶中已集满二氧化碳 |
| C |
探究物质溶解于水的热量变化 |
向一定量的水中加入 硝酸铵晶体,充分搅拌 |
溶液温度下降 |
物质溶于水都能使溶液温度下降 |
| D |
检验水垢中是否含有碳酸盐 |
取水垢加入稀盐酸,将气体通入澄清石灰水 |
产生气体使澄清石灰水变浑浊 |
水垢中含有碳酸盐 |
推理是化学学习中常用的思维方法。下列推理正确的是
| A.酸能使紫色石蕊溶液变红。通入CO2后的紫色石蕊溶液变红,所以CO2是酸 |
| B.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小 |
| C.酸性溶液的pH小于7。食醋是酸性溶液,所以食醋的pH小于7 |
| D.在同一化合物中,金属元素显正价,所以非金属元素一定显负价 |
下列物质的鉴别方法正确的是
| A.用食盐水鉴别硬水和软水 | B.用水鉴别碳酸钙固体和氯化钠固体 |
| C.用澄清石灰水鉴别氢气和一氧化碳 | D.用无色酚酞鉴别碳酸钠溶液和氢氧化钠溶液 |
实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染。于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属。实验过程如下: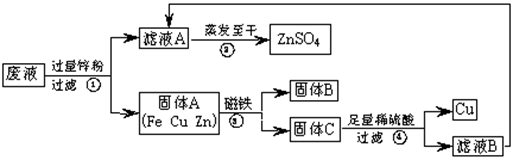
请回答:
(1)滤液A和滤液B含有相同的溶质,其名称是 ;固体B的化学式为 。
(2)写出步骤①其中一个反应的化学方程式 ;步骤④发生反应的化学方程式为 。
(3)要检验步骤④中加入的稀硫酸是否足量的方法是 。
除去下列各物质中的少量杂质所选用的试剂及操作方法均正确的是
| 项目 |
物质 |
杂质(少量) |
试剂 |
操作方法 |
| A |
KCl |
MnO2 |
足量的水 |
溶解、过滤、蒸发 |
| B |
H2 |
水蒸气 |
适量的NaOH溶液 |
洗气 |
| C |
FeSO4溶液 |
CuSO4溶液 |
过量的Fe粉 |
过滤 |
| D |
CO |
CO2 |
足量氧化铁 |
加热 |
印刷铜制电路板的“腐蚀液”为FeCl3溶液。已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2。现将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是
| A.溶液中一定含FeCl3,固体一定是铁和铜 |
| B.溶液中一定含FeCl2,固体一定含铜 |
| C.溶液中一定含FeCl2、CuCl2,固体一定含铜 |
| D.溶液中一定含FeCl2,固体一定是铁和铜 |
有一包粉末,可能由KCl、K2SO4、K2CO3、CuCl2、MgCl2中的一种或几种物质组成。现做如下实验:
实验一:取少量粉末,加水溶解后得到无色透明溶液①。
实验二:取①溶液少许,加入氢氧化钠溶液后看不到明显现象。
实验三:另取①溶液少许,加入适量氯化钡溶液后出现白色沉淀。过滤后得到滤液②,在沉淀中加入适量稀硝酸,沉淀全部溶解。
实验四:取滤液②少许,滴加少量硝酸银溶液出现白色沉淀,在沉淀中加入足量稀硝酸,沉淀不溶解。
根据以上实验,请回答:
(1)原粉末中一定没有______________________________,一定有_________________。
(2)原粉末中可能有_______________________,为了验证可能含有的成分是否存在,请你设计实验证明:
某学校“我与化学”学习小组发现,铜绿 [Cu2 (OH)2CO3] 受热分解后,除生成CO2和水蒸气外,试管中还有一些黑色粉末状固体。于是他们就通过实验探究分析黑色固体的组成,并验证产生的气体。请你参与一起分析探讨:
(1) 试管中的黑色团体可能是炭粉, 也可能是氧化铜, 还可能是 。
(2) 经查阅资料可知炭粉不能与酸反应,也不溶于酸,而氧化铜则可与酸反应而溶解。于是他们先向试管中的黑色固体里加入一种溶液来检验黑色固体究竟是什么?你认为他们可加的溶液是 (填化学式)
(3) 具体分析如下:假如黑色固体是炭粉,应该看到的现象 ;如果发现 ,该黑色固体则是氧化铜;假如现象为 ,才证明第三种可能成立。
(4) 若用右图装置验证两种气体生成物,应将生成的混合气体
先通过 (填“A”或“B’’”)装置,不然就会
有影响,原因是 。
当将气体通入装置A进行验证时,气流应从 通入。
试题篮
()