钙在冶炼工业中具有重要的作用。可采用电解熔融氯化钙的方法生产钙,反应的化学方程式为
 。若制得
,计算参加反应的
的质量(写出计算过程及结果)。
。若制得
,计算参加反应的
的质量(写出计算过程及结果)。
纯碱可用于造纸、玻璃生产等领域。纯碱产品中常含有少量的氯化钠杂质,某兴趣小组的同学为测定某品牌纯碱样品中碳酸钠的质量分数,设计了如图方案并进行实验。
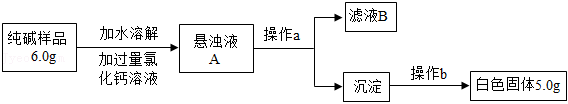
(1)滤液 中含有的阳离子有 __________(填化学符号)。
(2)若沉淀不经过操作 会使测定结果 _____(填“偏大”、“偏小”或“无影响”)。
(3)根据以上数据计算该样品中碳酸钠的质量分数(写出计算过程,结果精确至 )。
化肥对提高农作物的产量具有重要作用,尿素 是最常见的化肥之一。
(1)尿素属于_____(填标号)。
| A. | 氮肥 |
| B. | 磷肥 |
| C. | 钾肥 |
| D. | 复合肥 |
(2)尿素中氮元素的质量分数是_____ (结果保留到小数点后一位)。
(3)工业上生产尿素的反应为 。若生产 尿素,理论上需要氨气的质量是多少?(写出计算过程)

某化学兴趣小组研究影响化学反应快慢的因素。
(1)下图是实验室中常用的仪器
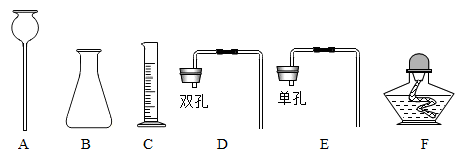
①仪器A的名称是_______。
②从上图中选择合适的仪器组装一套 发生装置,要求添加盐酸无需拆开装置,需要用到的仪器有哪些?_______(填标号)
(2)该小组的实验设计和数据记录如下表。每个实验均在反应开始后,就立即用排水法连续收集多瓶 ,表中“—”表示气泡太少,不再收集。
序号 |
反应物 |
收集每瓶气体所用时间(单位:秒) |
|||||||
盐酸 浓度 |
盐酸 体积 |
大理石 形状 |
第1瓶 |
第2瓶 |
第3瓶 |
第4瓶 |
第5瓶 |
第6瓶 |
|
实验1 |
|
|
小颗粒 |
|
|
|
|
|
|
实验2 |
块状 |
|
|
|
|
|
|
||
实验3 |
|
|
小颗粒 |
|
|
|
|
|
|
实验4 |
块状 |
|
|
|
|
|
|
||
实验5 |
|
|
小颗粒 |
|
|
|
|
|
— |
实验6 |
块状 |
|
|
|
— |
— |
— |
||
①该小组研究了哪些因素对反应快慢的影响?_______
②为了分析浓度对反应快慢的影响,可对比表中实验_______(填标号)。
| A. |
|
B. |
|
C. |
|
D. |
|
③根据实验数据反映出的规律,表中数值 的合理范围是:_______< <_______。
(3)该小组在反应开始后立即收集第1瓶气体,你认为该做法合理吗?说出你的观点并阐述理由。__。
粮食安全是国家安全的重要基础,化肥对提高粮食产量有重要作用。尿素【
】是常用的氮肥之一,可促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量。已知:

(1)尿素中氮元素的质量分数为_____(结果精确到 )。
(2)巴中某农业合作社需要 吨尿素,请计算合成这些尿素需要 的质量是多少吨。(写出计算过程)
已知某种钾肥是 和 的混合物,为测定二者的质量比,在烧杯里放入一定质量的该钾肥样品,加入适量水,完全溶解后,再向其中加入 溶液至恰好完全反应,得到 溶质质量分数为 的 溶液,并生成 白色沉淀。
请计算:
(1)该钾肥样品中钾元素的质量。
(2)该钾肥样品中 与 的质量比(用最简整数比表示)。
某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数,先将10g样品放入烧杯中,再把100g稀盐酸分5次加入该样品中(该实验条件下,杂质不与酸反应,也不溶解于水,忽略稀盐酸挥发),得实验数据如表格。
稀盐酸的质量 |
充分反应后剩固体的质量 |
第一次加入20g |
8g |
第二次加入20g |
6g |
第三次加入20g |
4g |
第四次加入20g |
2g |
第五次加入20g |
2g |
请计算;
(1)10g石灰石样品中碳酸钙的质量分数是 。
(2)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
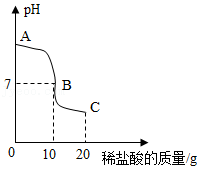
常温下,一锥形瓶中盛有10g溶质质量分数为4%的氢氧化钠溶液,先向其中滴加2滴酚酞试液,再逐滴滴加一定溶质质量分数的稀盐酸,用pH传感器测得溶液pH与加入稀盐酸的关系曲线如图所示,请回答下列问题:
(1)图中B点溶液呈 色。
(2)计算稀盐酸中溶质质量分数。(写出计算过程)
有一包从海水中获得的粗盐,已经经过初步提纯。课外活动小组对它的成分进行探究,并将粗盐进一步提纯。
一些物质的溶解性
OH﹣ |
Cl﹣ |
SO42﹣ |
CO32﹣ |
|
H+ |
溶、挥 |
溶 |
溶、挥 |
|
Na+ |
溶 |
溶 |
溶 |
溶 |
Ca2+ |
微 |
溶 |
微 |
不 |
Ba2+ |
溶 |
溶 |
不 |
不 |
Mg2+ |
不 |
溶 |
溶 |
微 |
探究过程:
Ⅰ.探究一:这包粗盐中可能有的杂质是CaCl2和MgCl2。
现用实验验证这种假设:取样品并溶解,加入数滴NaOH溶液,无明显现象,说明粗盐中无 ;另取样品并溶解,加入数滴碳酸钠溶液,有白色沉淀生成。
实验证明:这包粗盐中含有的杂质是 。
Ⅱ.探究二:这包粗盐中NaCl的质量分数。按下面步骤进行实验:
①称取ag的样品;
②将样品加水溶解,制成粗盐溶液;
③向粗盐溶液中加入过量的某种试剂,过滤,得到沉淀和滤液;
④将③中所得沉淀洗涤后小心烘干,称量得到bg纯净固体M;
⑤向③中所得滤液逐滴滴入稀盐酸,直到不再产生气泡为止后,移入蒸发皿蒸发,称量得到cg纯净固体N。
(1)②③⑤的步骤中,都使用到同一仪器是 ;它在步骤②和⑤中的操作方法相同,但目的不同,在步骤②中的目的是 。
(2)步骤③中加入的试剂是 ;目的是 。
(3)根据以上实验可知粗盐中NaCl的质量分数为 (用含字母的代数式表达)。
某溶液可能含有盐酸、硫酸、硝酸钾、氯化铜中的一种或几种,为了探究其组成,向一定质量的该溶液中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。下列相关说法正确的是( )

A.反应过程生成的沉淀一定有氢氧化铜,可能有硫酸钡
B.加入氢氧化钡溶液至过量,共发生了三个化学反应
C.该溶液一定含有盐酸、氯化铜,可能含有硝酸钾
D.到达b点时所消耗氢氧化钡溶液中溶质的质量是34.2g
孔雀石的主要成分是Cu2(OH)2CO3,还含有Fe2O3、Al2O3、SiO2杂质,用该矿石制备Cu的流程如图所示(部分产物略去):
 (1)过程①中,操作a是溶解和 ,还有一种气体产物是 ,滤液X中含有的金属阳离子为 。
(1)过程①中,操作a是溶解和 ,还有一种气体产物是 ,滤液X中含有的金属阳离子为 。
(2)过程①中硫酸略过量,则过程②调pH除杂的最佳试剂是 (选填“CuO”或“Na2CO3”)。
(3)下列关于制取铜的两种方案的说法,正确的是 。
A.“方案一”得到的铜产品更纯
B.“方案一”不存在消耗能量的问题
C.“方案二”需考虑废气污染的问题
D.“方案二”得到纯铜的产率更高
(4)过程③发生的反应:2CuSO4+2H2O 2Cu+O2↑+ (补充完方程式),当收集到800t氧气时,产生Cu的质量是多少?(写出必要的计算过程)
2Cu+O2↑+ (补充完方程式),当收集到800t氧气时,产生Cu的质量是多少?(写出必要的计算过程)
某实验小组验证“Fe+Ag2SO4═FeSO4+2Ag”反应并进行了如下探究。已知银粉为黑色,22℃时Ag2SO4的溶解度为0.8g。
①22℃时,向盛有硫酸银饱和溶液的烧杯中加入过量铁粉,搅拌静置,观察到溶液变为黄色并逐渐加深。
②静置3小时后观察,烧杯底部仍有黑色粉末,溶液黄色几乎消失。
③用pH试纸检测Ag2SO4、FeSO4溶液,测得pH均小于7。
回答下列问题:
(1)22℃时,硫酸银饱和溶液显 性(填“酸”“碱”或“中”),其溶质质量分数为 。(列出计算式即可)
(2)取步骤①上层的黄色溶液少许滴加盐酸,观察到白色沉淀,该沉淀的化学式为 。
(3)某同学由步骤②中“仍有黑色粉末”得出Fe比Ag活泼的结论。小组同学讨论后认为思维不严密,因为黑色粉末不一定含Ag,还可能是 ,需要进一步实验才能得出结论,该实验方案是:取黑色粉末少许, 。(补充完实验方案)
(4)溶液呈黄色是因为含有Fe3+离子。小组对Fe3+产生的原因作出如下假设:
a.可能是铁粉表面有氧化物,可产生Fe3+;
b.空气中的O2能与Fe2+反应,可产生Fe3+;
c.溶液中存在 离子能与Fe2+反应,可产生Fe3+。
请设计实验证明假设a、b不是产生Fe3+的主要原因。实验方案是:向同样的铁粉中加入FeSO4溶液,振荡静置,观察到 时即可证明。
某石灰水中含有氢氧化钙1.48g,要使该石灰水中的氢氧化钙转化为碳酸钙沉淀,至少需要二氧化碳的质量是多少?
某化学兴趣小组以A装置为核心装置设计了如图系列实验:(固定装置的仪器已省略)

按如图所示连接仪器,检查整套装置的气密性良好,添加药品,固定装置,进行实验。
(1)关闭K2,打开K1,将H2O2溶液缓缓滴入锥形瓶中,待D装置中出现连续均匀气泡时点燃C装置中的酒精灯,观察到V型管内a处的硫燃烧,现象是 ,试写出在D装置中反应的化学方程式 ,待V型管内的硫燃尽后仍要继续通一段时间的氧气,目的是 。
(2)打开K2,关闭K1,继续将H2O2溶液缓慢滴入锥形瓶,观察到装置E中
(填现象),说明氢氧化钠和稀盐酸一定发生了反应。
(3)兴趣小组有同学提出疑问:E装置内反应后的废液中除酚酞以外还有哪些溶质呢?请你一起参与探究。
【作出猜想】
猜想一:NaCl
猜想二:NaCl和NaOH
猜想三: 。
【分析】以上有一种猜想一定错误,请写出错误猜想的序号及错误理由 。
【资料】NaCl的水溶液呈中性。
【设计并进行实验】排除了错误猜想后,为了验证其余猜想,同学们进行了如下实验:
实验操作 |
实验现象 |
实验结论 |
取少量E装置中的废液于试管中,并向其中加入① 。 |
② |
猜想三正确 |
【交流反思】该废液未经处理不能随意倒入水池。
试题篮
()