下列实验方案中,能达到实验目的的是:
| 选项 |
实验目的 |
实验方案 |
| A |
除去混入CO2 中的O2 |
通过炽热的木炭层 |
| B |
确认粉末中含有MnO2 和CuO |
加入过量的过氧化氢溶液 |
| C |
从CaCO3 和CaO的混合粉末中得到CaCO3 |
加入足量的稀盐酸,过滤 |
| D |
从AgNO3 和Zn(NO3)2的混合溶液中得到Ag |
加入适量的铜粉,过滤 |
实验方案中,不能证明氢氧化钠溶液与稀盐酸发生了化学反应的是
| A.向一定量的氢氧化钠溶液中通入二氧化碳后再滴加稀盐酸,有气体生成 |
| B.向装有一定量氢氧化钠溶液的烧杯中滴几滴酚酞溶液,再不断滴入稀盐酸 |
| C.用pH试纸测氢氧化钠溶液pH,再滴加稀盐酸,pH逐渐降低,最终小于7 |
| D.向装有少量稀盐酸的试管中滴加足量氢氧化钠溶液,再向其中滴加碳酸钠溶液 |
下列转化不能一步实现的是( )
| A.CO→CO2 | B.H2O→H2 | C.Ca(OH)2→NaOH | D. KNO3→KCl |
已知某合金样品中可能含有铝、铁、铜中的两种或三种。某小组同学对该合金样品的成分进行探究。
【查阅资料】铝与氢氧化钠溶液可以发生反应,而铁、铜不与氢氧化钠溶液反应。
已知2Al + 2NaOH + 2X= 2NaAlO2 + H2↑,则X的化学式是 。
【探究实验】
| 实验方案 |
实验现象 |
结论 |
| ①取一定量的合金样品,加过量的 ,充分反应后过滤,滤渣备用。 ②取步骤①所得滤渣,加 。 |
样品部分溶解,并有气体放出。 |
合金中一定含有 。 合金中一定含有铁和铜。 |
【拓展探究】某同学进一步验证铝、铁、铜三种金属的活动性顺序,他设计了以下四种实验方案,其中能达到实验目的的是 (填字母序号)。
A.将Al、Cu分别加入到FeSO4溶液中
B.将Al、Fe分别加入到CuSO4溶液中
C.将Al分别加入到FeSO4、CuSO4溶液中
D.将Fe分别加入到Al2(SO4)3、CuSO4溶液中
下列实验不能达到目的的是
① ② ③ ④
| A.①验证可燃物燃烧的条件 |
| B.②检验碳酸根离子的存在 |
| C.③实验室用过氧化氢溶液与二氧化锰制取氧气 |
| D.④探究分子在不断地运动 |
除去下表中各物质(A、C为溶液)中的少量杂质,所选用的试剂、方法正确的是
| 编号 |
物质 |
杂质(少量) |
试 剂 |
除杂操作方法 |
| A |
NaCl |
CaCl2 |
过量Na2CO3溶液 |
过滤 |
| B |
KNO3 |
NaCl |
H2O |
冷却热饱和溶液,过滤 |
| C |
FeSO4 |
CuSO4 |
过量锌粉 |
过滤 |
| D |
CO2 |
CO |
/ |
点燃 |
下列有关化学实验的“目的→操作→现象→结论”的描述都正确的是
| 选项 |
目的 |
操作 |
现象 |
结论 |
| A |
比较铝和铜的金属活动性 |
将砂纸打磨过的铝丝 浸入到硫酸铜溶液中 |
铝丝表面有红色固体析出 |
铝比铜活泼 |
| B |
检验露置在空气中的氢氧化钠溶液是否变质 |
取氢氧化钠溶液,滴入稀盐酸 |
开始时没有观察到气泡产生 |
氢氧化钠溶液没有变质 |
| C |
探究物质溶解于 水时的热量变化 |
向一定量水中加入硝酸铵晶体,充分搅拌 |
溶液温度下降 |
盐类物质溶解于水时,都会吸热 |
| D |
检验集气瓶中是否集满二氧化碳 |
将燃着的木条伸入集 气瓶中 |
木条火焰熄灭 |
集气瓶中已集满 二氧化碳 |
FeCl3溶液腐蚀铜、铁的反应分别为:Cu+2FeCl3=2FeCl2+CuCl2、Fe+2FeCl3=3FeCl2。
从腐蚀过镀铜器件的废液中回收铜,并重新制得FeCl3的流程如下: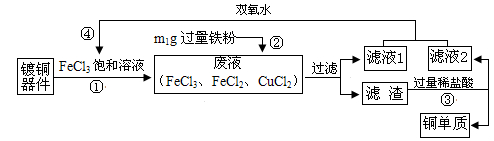
下列说法不正确的是
| A.步骤②中发生化合反应与置换反应 |
| B.“滤液1”中一定含FeCl2,可能含CuCl2 |
| C.步骤④反应为:2M+2FeCl2+ H2O2=2FeCl3+2H2O,M是HCl |
| D.若滤渣也为m1g,则废液中FeCl3与CuCl2的质量比为65∶54 |
除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是
| |
物质 |
杂质 |
除杂质应选用的试剂和操作方法 |
| A |
CO2 |
CO |
通入O2点燃 |
| B |
NaOH固体 |
Na2CO3固体 |
加入过量盐酸,蒸发 |
| C |
Cu(NO3)2溶液 |
AgNO3溶液 |
加入过量的铜粉,过滤 |
| D |
KCl溶液 |
KOH溶液 |
加入过量的CuCl2溶液,过滤 |
新型材料纳米级Fe粉在空气中易自燃,它能用作高效催化剂。实验室采用还原法制备纳米级Fe粉,其流程如图所示:
下列说法错误的是
| A.将FeCl2﹒nH2O加热脱水干燥的原因可能是生成的纳米级铁粉会与水反应。 |
B.Ⅱ中反应的化学方程式为 H2+FeCl2 Fe+2HCl Fe+2HCl |
| C.纳米级Fe粉比普通 Fe粉更易与氧气反应 |
| D.实验中通入的N2只起到防止纳米级铁粉自燃的作用 |
除去下列物质中的少量杂质所选用的试剂或方法正确的是
| 选项 |
物质 |
所含杂质 |
所选用试剂或方法 |
| A |
NaOH溶液 |
Na2CO3溶液 |
稀盐酸 |
| B |
CaO |
CaCO3 |
高温灼烧 |
| C |
CO2 |
CO |
点燃 |
| D |
稀盐酸 |
稀硫酸 |
加适量Ba(NO3)2溶液,再过滤 |
某兴趣小组设计了探究Zn、Cu、Ag三种金属活动性顺序的四组方案,你认为不可行的是
| A.在两支试管中各装少许ZnSO4溶液,分别加入铜片和银片 |
| B.在两支试管中各装少许CuSO4溶液,分别加入锌片和银片 |
| C.向盛稀盐酸的两支试管中,分别加入锌片和铜片,再向盛AgNO3溶液的试管中,加入铜片 |
| D.向盛有ZnSO4溶液和AgNO3溶液的两支试管里分别加入铜片 |
某兴趣小组的同学,利用含有铁锈的铁粉制取四氧化三铁,在实验过程中还需要用到的仪器和药品合理的是
| A.b(稀硝酸、锌粒)、c、d | B.a(稀硫酸、锌粒)、c(高锰酸钾)、d、e |
| C.a(双氧水、二氧化锰)、d | D.c(氯酸钾、二氧化锰)、d(一氧化碳) |
某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】①CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关;
②CO还原Fe2O3的实验过程中固体产物可能有Fe3O4、FeO、Fe;
③NaOH溶液与石灰水相似,能吸收CO2,但不变浑。
④
| 物质性质 |
四氧化三铁 |
氧化亚铁 |
氧化铁 |
铁粉 |
| 颜色 |
黑色 |
黑色 |
红色 |
黑色 |
| 能否被磁铁吸引 |
能 |
不能 |
不能 |
能 |
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 。
(2)进行猜想:黑色固体粉末可能a.全部为铁、 b. 、c. 。
【得出结论】
(3)通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称) 。
【反思与评价】
(4)一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度。
(5)实验装置图中采用虚线框内的装置,其作用有 。
A.收集CO B.吸收CO2 C.检验CO2
【实践应用】小明和他的同学想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。
(6)上述反应产生CO2的质量为 g;
(7)计算该赤铁矿石中氧化铁的质量分数。 。(需要有计算过程)
试题篮
()