粗盐中含有MgCl2、CaCl2等杂质,工业提纯粗盐的工艺流程如下图所示:
(1)Ca(OH)2溶液的pH (填“>”、“=”或“<”)7。步骤①反应的化学方程式为 。
(2)步骤③操作a的名称是 。步骤④加入适量盐酸的目的是除去滤液中的Na2CO3和 。
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有 。
实验室提供下列盛有药品的仪器,甲、乙、丙兴趣小组对某混合气体进行研究,混合气体的主要成分为CO,含有少量的CO2和水蒸气。
资料库:浓硫酸具有吸水性,可作干燥剂,不与CO、CO2反应 。
(提示:选用的仪器用A、B、C、D表示,可以重复使用)。
(1)甲组:分别证明混合气体中含有某一种气体)。
① 证明其中含有CO2,选用仪器是 。
②证明其中含有水蒸气,选用仪器是 ,出现的实验现象是 。
③证明其中含有CO,按气体通过的先后顺序依次是 。
④ 一氧化碳还原氧化铜的化学方程式: 。
(2)乙组:通过一次实验证明混合气体中含有CO2、CO和水蒸气。按气体通过的先后顺序,连接的仪器依次是 。
(3)丙组:用干燥纯净的CO还原氧化铜,并检验其生成的气体。按气体通过的先后顺序,连接的仪器依次是 。
(4)从环境保护角度出发,乙、丙组实验中最后导出的尾气的处理方法是________ 。
2010年全国“两会”代表和委员们首次使用环保“石头纸”制作的便笺和文件袋。“石头纸”是一种低碳经济的绿色产品,它的主要成分是一种难溶性钙盐。某化学兴趣小组的同学对“石头纸”的成分进行如图所示的实验探究,观察到澄清石灰水变浑浊。请回答下列问题:
(1)生活中_________的主要成分和“石头纸”的主要成分相同。
(2)写出装置A中发生的反应的化学方程式:
_____________________________________________。
(3)请说出你在日常生活中符合“低碳生活”的做法_____________________。(列举一例即可)
已知Cl2通入水中形成的溶液叫氯水。发生的反应为:
Cl2 + H2O =" HCl" + HclO(次氯酸)、 2HClO  2HCl + O2↑。
2HCl + O2↑。
(1)HClO中氯元素的化合价为 。
(2)将氯水在阳光下照射一段时间后,溶液中的溶质是 (填化学式)。任写一个体现该溶液化学性质的方程式: 。
(3)往新制氯水中放入一小块红色布条,一段时间后观察,红布条褪色。请对此现象进行探究(只需提出假设、方案,不需要说出方案实施的具体结果)。
假设一:生成的HClO使红布条褪色
方案一:往新制备的HClO溶液中放入一小块红布条,一段时间后观察布条颜色变化。
假设二: 。
方案二: 。
假设三: 。
方案三: 。
测定空气中氧气的体积分数可以采用下图甲乙两种装置。乙装置可视为甲的改进装置,在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化。
(提示:铜丝在空气中加热和氧气反应生成黑色固体氧化铜)

在甲装置实验过程中,红磷燃烧集气瓶中充满白烟,一段时间后,自动熄灭了,你认为原因是____(14)___。
(3)冷却后,松开止水夹,你观察到的现象是_____(15)________
(4)从这个实验得出的结论是____________(16)__________
(5)写出红磷燃烧的化学表达式 (17)
(6)在乙装置实验加热过程中,交替缓慢推动两个注射器活塞的目的是 (18)
(4)乙装置实验中测得实验结果如下:
| 反应前注射器内气体总体积 |
反应后注射器内气体总体积 |
| 25mL |
22mL |
由此数据可以推算出测定的空气中氧气的体积分数 (19) 2l%(填“>”、“=”或“<”)。
在实验课上,老师给了同学们一包红色的粉末,该粉末是铜粉和氧化铁中的一种或两种.同学们为了确定该粉末的成分,进行了如下探究。请你参与他们的探究并回答问题.
(1) [提出假设] 假设1:红色粉末是铜粉; 假设2:红色粉末是氧化铁粉;
假设3:红色粉末是 .
(2) [设计实验方案]同学们对实验作了如下的设想和分析:取少量红色的粉末放入硬质的玻璃管中,通入一氧化碳,加热至充分反应(如下图)。请你完成下列表格:
| 实验中可能出现的现象 |
结论 |
| |
假设1成立 |
| |
假设2成立 |
| |
假设3成立 |
(3) 通过分析假设3成立.
(4) [反思与评价]
①实验时通入一氧化碳片刻后加热的原因是
.
②指出上述设计的实验中不足之处
.
③以氧化铁为原料,用上述方法炼铁的反应化学方程式______________________________
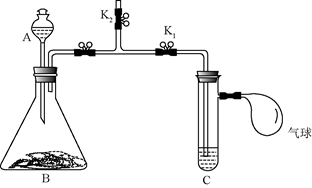
实验1:
步骤1:在
中加入少量白磷并加入热水,塞好胶塞使导管口进入热水中发现白磷不燃烧;
步骤2:打开
,关闭
,将
中的溶液滴入
中,
中有气泡冒出,白磷燃烧,
中发生的化学方程式为.通过以上实验研究了燃烧的一个条件。它是.
实验2:研究
与
固体的反应
步骤1:
中盛有稀盐酸、
中
固体,
中
固体打开
,关闭
,将
中溶液滴入
中,气球变大,打开
,关闭
,一段时间后气球没有明显变瘪。
步骤2:依据以上实验现象,改进后重新添加药品,进行实验2.
步骤3:打开
,关闭
,将
中液体滴入
中,用燃着的木条放在
上,发现木条熄灭,问上述操作的目的。然后进行后续实验,说明
与
固体发生了反应,后续实验的操作与现象为。
一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学,合成气可通过天然气的重整得到,如CH4+H2O═CO+3H2。合成气可制二甲醚,二甲醚被称为21世纪的新型燃料。合成气还可用于冶炼金属。请你仔细阅读合成气冶炼粗铜和制取二甲醚的部分生产流程,回答下列问题:
(1)铜绿[化学式为Cu2(OH)2CO3]中碳元素、氧元素的质量比为 。合成气在与黑色固体冶炼粗铜的生产过程中发生的反应方程式为 (写出其中一个反应)。
(2)二甲醚(CH3OCH3)可由合成气(CO和H2)在一定的条件下制的。用合成气制二甲醚时,还产生了一种常温为液态的氧化物,写出该反应的化学方程式: 。
(3)上述生产流程的突出优点是 。
(4)合成气(CO和H2)在不同催化剂的作用下,可以合成不同的物质。仅用合成气为原料不可能得到的物质是 (填字母序号)。
A.草酸(H2C2O4) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
老师为同学们提供了如下实验装置:
(1)写出仪器a名称: .
(2)实验室用加热高锰酸钾制取氧气时采用A装置作发生装置,写出高锰酸钾制取氧气的化学反应方程式______________________________。 若要收集一瓶氧气,供“硫在氧气中燃烧”实验使用,最好选择的气体收集装置是F,理由是①____________________,②_____________________。
(3)实验室制取二氧化碳发生装置可选用装置B或装置C,装置C与装置B相比,装置C优点是 。二氧化碳的收集装置是_____(填装置字母),实验室制取二氧化碳的化学方程式为 。
(4)甲烷化学式为 CH4,甲烷密度比空气小、难溶于水,CH4可以用下图装置收集,请填写进气管的字母代号:
若用图1装置收集,CH4从 端通入;若用图2装置收集,CH4从 端通入。
NaOH是重要的化工原料,研究其制备、检验、贮存及应用具有重要意义。
(1)工业上常用电解饱和食盐水的方法制取NaOH,反应的化学方程式为2NaCl+2H 2O 2NaOH+Cl 2↑+X↑.X的化学式为 。
(2)为了探究NaOH样品中是否存在NaCl、Na 2CO 3杂质,设计如下实验方法 
注:AgCl是白色固体,难溶于水和稀HNO 3
①乙中有无色无味气体产生,证明样品中含有Na 2CO 3.产生气体的化学方程式为 。
②试剂X为 溶液;可证明NaCl存在的现象是 。
(3)某兴趣小组试图通过测定生成的CO 2质量,确定因久置而变质的NaOH固体中Na 2CO 3的质量分数,设计了图所示装置并进行如下实验:
步骤一:取一定质量的样品,加入气密性良好的锥形瓶中,然后在分液漏斗中加入足量的稀硫酸,称出装置总质量为m 1。
步骤二:打开分液漏斗旋塞,逐滴加入稀硫酸,待气泡不再产生时,关闭旋塞,称出装置总质量为m 2。

①球形干燥管中不用NaOH固体而用CaCl 2固体的原因是 。
②小明同学认为(m 1﹣m 2)即为生成的CO 2质量,小红同学认为小明的想法不合理,理由是 。
(4)某工厂化验室用20%NaOH溶液洗涤一定量石油产品中残余H 2SO 4,共消耗NaOH溶液20g,洗涤后的溶液呈中性。这一定量石油产品中所含H 2SO 4的质量为 (写出计算过程,否则不得分)。
请根据下图回答问题:

① 将图1和图6连接可以制取氧气,反应的化学方程式为 ,证明氧气已经集满的现象是 。若用图6收集一瓶含1/4空气的氧气,操作的方法是 。
② 图2中仪器A的名称为 ,它在装置中的主要作用是 。甲同学用图2和图 连接来制取二氧化碳,装置中加入盐酸的量至少要 。
③ 乙同学在图2基础上增加了一块带孔的隔板(如图3),则大理石应放在 处(填“a”或“b”),该装置中加入盐酸的量至少要 ;若加入盐酸过多,则有可能产生的后果是 ,要使反应停止,其操作是 。
④ 丙同学用过氧化氢溶液和二氧化锰制取氧气,反应的化学方程式为 。反应前他事先往试管中加入了少量的水,甲同学由此产生了疑问,提出了猜想:
猜想1:加水可以起到稀释的作用,使反应速度变缓。
猜想2:……
甲同学根据猜想进行了实验:每次取15mL 15%的过氧化氢溶液,稀释成不同溶质
质量分数,在其他条件相同的情况下进行实验。记录数据如下:
| 实 验 |
1 |
2 |
3 |
4 |
5 |
| 过氧化氢溶液溶质质量分数 |
1% |
3% |
5% |
10% |
15% |
| MnO2粉末用量/g |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
| 收集到500mL气体时所用时间/s |
560 |
186 |
103 |
35 |
12 |
| 反应后液体温度/℃ |
26 |
38 |
43 |
59 |
71 |
根据表中数据可知:过氧化氢溶液的溶质质量分数对反应速度的影响是 。
甲同学的猜想2是:加水可以 。
小明和小红对市场上销售的一种真空充气包装的形如小枕头“蛋黄派”发生了兴趣,如下图所示.他们查阅资料获知:这种真空充气包装技术,即将食品装入包装袋,抽出包装袋内空气,再充入某种气体,然后封口.它能使食品保持原有的色、香、味及营养价值,防止食品受压而破碎变形.那么,这是什么气体呢?小红猜想是氮气,小明猜想是二氧化碳.
请你帮助他们设计一个简单的实验方案,来判断小明的猜想是否正确,简要写出操作步骤(方法、现象和结论):
| 实验步骤 |
现象 |
结论 |
| 用注射器抽取袋内气体,然后通入澄清的石灰水。 |
|
|
某实验小组为了除去铜丝网上的黑色物质(CuO),进行铜丝网的回收再利用,制定了如下两种方案。请根据方案回答:(提示:黑色铜丝网是铜和氧化铜混合物)
(1)甲方案的玻璃管中发生反应的化学方程式是 ,其中氧化铜失去氧,发生了 (填“氧化”或“还原”)反应。乙方案的烧杯中现象是 ,发生反应的化学方程式是_ 。两种方案相比较,甲方案明显的不足之处是 。
(2)若两种方案中加入的试剂均过量,则甲方案中回收的铜丝网的质量(填“<”、“>”、“=”) 乙方案中回收的铜丝网的质量。
(3)反应结束后,写出能证明乙方案中盐酸过量的实验操作和现象是 。
(4)若在乙方案反应后烧杯中的液体中加入足量的铁粉充分搅拌,最后得到的溶液中溶质为 。
下列有三种制取硝酸铜的方案:
方案一:Cu + 4HNO3(浓) = Cu(NO3) + 2NO2↑+ 2H2O
方案二:3Cu + 8HNO3(稀) = 3Cu(NO3) + 2NO↑+ 4H2O
方案三:2Cu + O2 + 4HNO3(稀)= 2Cu(NO3)2 + 2H2O
请你从经济、环保的角度分析考虑选择一种最适宜的方案 ,你选择方案而不选其它方案的理由是(写两点):
。
在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整。
【实验目的】铁生锈条件的探究。
【实验内容】取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象。
【实验现象】实验①②无明显现象,实验③中铁丝生锈,且试管内空气体积减小。
【实验结论】铁生锈实际上是铁与空气中的 (填名称)发生反应的结果。
【实验思考】
(1)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管体积的 。
(2)该实验创新之处在于:可根据铁丝表面的铁锈和 两种现象来判断铁丝反应进行的情况。
(3)铝比铁活泼,但铝难腐蚀,原因是 。
(4)金属资源储量有限且不能再生,为了保护金属资源,除防止金属的腐蚀外,你还有什
么合理的建议 。(答一点即可)
试题篮
()