某研究性学习小组同学在学习了酸、碱、盐的知识后,走进化学实验室.邀请你参加以下活动.(已知:① , 溶液呈碱性;② 微溶,但在稀溶液中看作可溶,其水溶液呈中性.)

(1)甲、乙两同学想用实验证明稀硫酸和稀
溶液确实能发生反应,设计了如图
所示的实验.丙、丁两同学想再现课本上将"澄清石灰水滴入
溶液"的实验现象,设计了如图
所示的实验。并各自进行操作.
【问题讨论】教师首先肯定了这四位同学的实验设计和操作,请你填空:
甲、乙同学将较多量的稀硫酸加入锥形瓶后,他们是依据溶液的颜色由色变为色的现象来判断两者确实发生反应的.丙、丁同学的实验中发生的复分解反应可用化学方程式表示为.
【意外发现1】甲同学和丙同学在洗刷仪器前,将
、
装置锥形瓶中的残留物倒入同一个洁净的废液缸,发现白色沉淀溶解,有气泡产生,废液缸中形成无色溶液.这一现象立刻引起了同学们的好奇,于是,他们又以"无色溶液中含有哪些溶质"为课题进行探究.
【提出猜想】经讨论呈现出如下猜想:
①溶质为:
、
②溶质为: 、 、
③溶质为: 、 、
请你判断:上述猜想中不合理的是(填数字代号).
【实验探究】小组同学针对认为合理的猜想,设计实验进行探究,请你将下表补充完整.
| 实验内容 |
实验现象和结论 |
| 取废液缸中少量溶液于试管中,滴入少量溶液,观察 |
a.若有气泡产生,则猜想成立(填数字代号) |
| b.若无气泡产生,则猜想成立(填数字代号) |
【意外发现2】乙同学和丁同学在洗刷仪器前,将 、 装置锥形瓶中的残留物倒入另一个洁净的废液缸,发现沉淀不溶,没有气泡,上层清液呈红色,此时,上层清液中溶质的组成情况可能有许多组,如:
① 、 ;
② 、 ;
③ 、 、 ;
④ 、;
⑤
、
、.(未列全.请用化学式将④、 ⑤补充完整)
(2)教师点拨:证明稀硫酸和
稀溶液确实能发生反应的方法还有多种.
【拓展探究】小组同学用其他装置继续进行实验.请你回答下列问题:
①若不加酚酞试液,将稀硫酸(适量)与
稀溶液混合后,再向其中加入
溶液,无蓝色沉淀生成,则(填"能"或"不能")证明两者确实发生了反应.
②若不加酚酞试液,将稀硫酸(少量)与
稀溶液?昆合后,再向其中加入
溶液至蓝色沉淀不再产生时,消耗了
溶液,此时还必须做一个对比实验才能证明两者确实发生了反应,这个对比实验是(简述操作方法及结论):.
还可以将上述
溶液换成溶液等(填一种物质的化学式),同样也可以证明稀硫酸和
稀溶液确实发生了反应.
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要.甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分
的含量进行测定.(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应)

(1)甲组同学称取一定质量的赤铁矿粉,采用如图6的装置进行实验.
①装置
中发生反应的化学方程式是.
②为充分吸收反应生成的
,装置
中应盛放的试剂是浓溶液.
③可以通过下面不同的方法计算赤铁矿粉中
的含量:
【方法一】称量反应前后
装置的总质量,计算出
的含量;
【方法二】称量得出反应生成的
质量,计算出
的含量.
(2)乙组同学称取等质量的赤铁矿粉放人烧杯中,向烧杯中加入过量的稀硫酸充分反应,(填一个操作名称)后立即称量.根据称量的数据计算出
的含量.
(3)甲、乙两组同学通过相互比较后对各自的实验方案进行评价.
| 方案 |
优点 |
| 甲组 |
① |
| 乙组 |
② |
过氧化氢(化学式
)溶液在
作催化剂的条件下能迅速分解生成
和
,分液漏斗可以通过调节活塞控制液体的滴加速度。
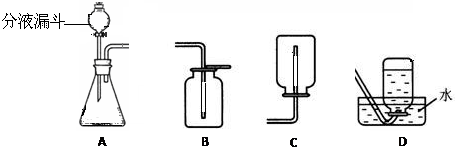
回答下列问题:
(1)分液漏斗中应放入的物质是,锥形瓶中应放入的物质是 。
(2)写出该方法制取
的化学方程式;要收集一瓶较纯净的
,应选择装置(填字母)。
(3)某同学在观察到锥形瓶内有大量气泡时,开始用B装置收集
,过一段时间后,用带火星的木条伸到瓶口,看到木条 ,表明已收集满。
(4)若实验时用此法代替
加热制取
,优点是 (填编号)。
①生成物只有氧气 ②不需加热 ③需加热
(5)装置A中反应很剧烈,据此提出实验安全注意事项是(填编号)。
①控制液体的滴加速度 ②用体积较小的锥形瓶 ③加热反应物
(6)写出用装置A制取另外2种气体的化学式 和 。
叠氮化钠(
)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【应用研究】
(1)汽车经撞击后,30毫秒内引发
,迅速分解为
,反应方程式为。
【制备研究】
(2)将金属钠与液态氨反应得
,再将
反应可生成
和
气体
,该反应的化学方程式为
,实验室检验
气体使用的试纸是湿润。
【
质量分数测定】
工业级
中常含有少量的
,为测定样品中
的质量分数设计如图装置(已知
溶液与
,反应不生成气体)。
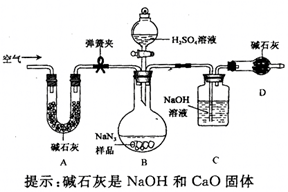
(3)装置
的作用是。设计的实验步骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置
;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,;⑤再次称量装置
。计算碳酸钠含量至少需要测定(填数字)个数据。根据制备反应,分析工业级
中含有
的可能原因。
| M |
【 纯度测定】
精确称量
样品,设计如图装置,测定其纯度。已知
(
中的
全部转化为
,其他产物略),反应中放出大量的热。
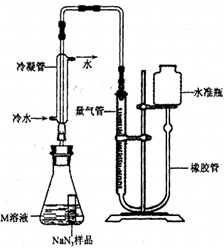
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差(填"变大"、"变小"或"不变"),说明气密性良好。
(5)使小试管中的
样品与
溶液接触的操作是。
(6)使用冷水冷凝的目的是。反应前应将液面调节到量气管的"0"刻度,并使两边液面相平,反应后读数时,还需要进行的操作是
(7)常温下测得量气管读数为67.2
的密度为1.25
),则实验中选用的量气管规格合适的是(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算
样品的纯度(写出计算过程)
试题篮
()