人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属.硅钢可用于制造变压器的铁芯,某化学兴趣小组的同学为了验证硅钢(主要含有Fe、C、Si),设计了如图的实验流程(有些反应的部分反应物和生成物已省略).

查阅资料发现:常温下,单质硅(Si)不能与盐酸反应,但能与氢氧化钠溶液反应(Si+2NaOH+H 2O═Na 2SiO 3+2H 2↑).
根据以上信息,回答下列问题:
(1)固体A的成分为 ,E的化学式为 ;
(2)滤液B中的金属阳离子为 ;
(3)在过滤操作时,若发现滤液浑浊,应 ;
(4)步骤⑤中发生的是化合反应,尝试写出其化学方程式 .
PLA是一种新型可降解塑料,能有效缓解塑料垃圾造成的白色污染。已知PLA由碳、氢、氧三种元素组成,为了测定7.2gPLA样品氧元素的质量,某化学兴趣小组进行了以下探究。
【实验设计】查阅资料,无水硫酸铜遇水由白色变成蓝色
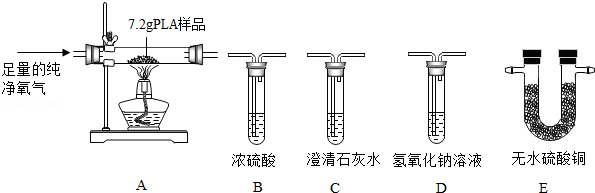
将7.2gPLA样品充分燃烧,为分别吸收燃烧产物并通过清晰可见的现象检验吸收是否完全,以上实验装置正确的连接顺序是:A→ → → → (填写装置的字母序号)。
【分析与结论】①实验中选择纯净的氧气而不用空气的原因是 。
②装置E的作用是 。
③正确连接装置后,确认气密性良好。充分燃烧7.2gPLA样品,测得相关实验数据见下表(已知燃烧产物被完全吸收,灰烬质量忽略不计)。
通过分析与计算,可知7.2gPLA样品中含有氧元素的质量为 克,该PLA样品中碳、氢、氧三种元素的原子个数最简整数比为 。
| 装置 |
B |
C |
D |
E |
| 实验前质量/g |
160 |
150 |
150 |
100 |
| 实验后质量/g |
163.6 |
150 |
163.2 |
100 |
铁及其化合物在生产生活中有广泛的应用。
(一)铁的应用和防护
(1)某麦片中含微量铁粉,食用后铁粉与胃酸反应转化为人体可吸收的铁元素,反应的化学方程式为 。
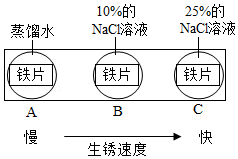
(2)铁锈主要成分是Fe 2O 3•nH 2O,铁生锈主要与空气中的 有关。
(3)如图实验说明NaCl在铁生锈中的作用是 。
(4)铁生锈的次要过程:Fe 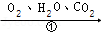 FeCO 3•nH 2O
FeCO 3•nH 2O  FeCO 3
FeCO 3
写出Fe转化为总反应的化学方程式 。
(5)为防止铁生锈,可对铁制品进行"发蓝"处理,使其表面生成致密氧化物(其中Fe、O元素质量比为21:8)保护膜,该氧化物的化学式为 。
(二)废铁的再利用
黄钠铁矾[NaFe x(SO 4) y(OH) z]是一种高效净水剂。用废铁屑(主要成分为Fe,含少量Fe 2O 3和FeCO 3)制备黄钠铁矾的主要流程如图:
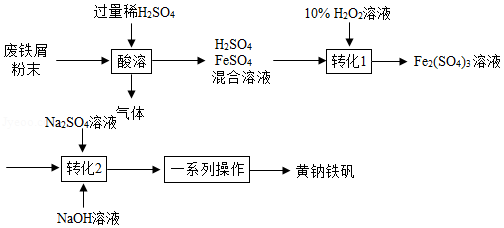
(1)将废铁屑研磨成粉末的目的是 。
(2)"酸溶"时H 2SO 4与Fe、FeCO 3反应,还发生反应的化学方程式有 和Fe+Fe 2(SO 4) 3=3FeSO 4。
(3)"转化1"发生反应的化学方程式为 。反应时温度不宜过高的原因是 。
(三)黄钠铁矾组成确定
称取9.70g黄钠铁矾,用如图装置进行热分解实验。
【资料】
①NaFe x(SO 4) y(OH) z在T 1℃分解会生成H 2O(气态),提高温度至T 2℃继续分解产生SO 3气体,并得到Fe 2O 3和Na 2SO 4。
②浓硫酸可用于吸收SO 3。
(1)装配好实验装置后,先要 。
(2)分别控制温度在T 1℃、T 2℃对A中固体加热。
①控制温度在T 1℃加热,实验后测得B装置质量增加1.08g。
②用D装置替换B装置,控制温度在T 2℃,加热至反应完全。
③T 1℃、T 2℃时,加热后均通入一段时间N 2,目的是 。
(3)反应完全后,将A装置中固体溶于足量水,过滤、洗涤、烘干得4.80g固体,将滤液蒸干得1.42g固体(不含结晶水)。
结论:NaFe x(SO 4) y(OH) z中,x:y:z= 。
反思:若该实验过程中缺少C装置,则x:z的值 (选填"偏大""偏小"或"不变")。
某化学兴趣小组的同学学习"灭火器原理"后,设计了如图所示实验,并对反应后瓶中残留废液进行探究。

【提出问题】废液中所含溶质是什么?
【猜想与假设】
猜想1:废液中的溶质可能是NaCl、Na 2CO 3和HCl。
猜想2:废液中的溶质只有NaCl。
猜想3:废液中的溶质是NaCl和HCl。
猜想4:废液中的溶质是 。
【讨论与交流】
小明认为猜想1无需验证就知道是错误的,他的理由是 。(请用化学方程式说明)
【实验与结论】
(1)小亮同学为验证猜想3,取少量废液装入试管中,然后滴入酚酞溶液,发现酚酞溶液不变色,于是小亮认为猜想3正确。你认为他的结论 (填"正确"或"错误"),理由是 。
请你另设计实验方案验证猜想3:
| 实验步骤 |
实验现象 |
实验结论 |
|
|
|
猜想3正确 |
(2)验证猜想4,可选用的试剂有 。
A.酚酞溶液 B.氢氧化钾溶液 C.稀硫酸 D.氯化钡溶液。
【拓展与应用】
若废液中的溶质是NaCl和HCl,根据HCl的性质,无需另加试剂,只要对废液进行 操作即可从废液中得到NaCl固体。
在学了生活中常见盐的性质以后,某校化学兴趣小组的同学开展了测定Na 2CO 3和NaCl混合固体中Na 2CO 3含量的探究实验,他们设计了如下的实验方案:

(1)如图甲所示(铁夹夹持的仪器是注射器),把一定量的混合物与足量稀硫酸反应后,测定产生的二氧化碳气体的体积,检查该装置的气密性的方法是: ;
(2)小明同学提出用图乙代替图甲中的收集装置,则所测CO 2气体的体积 (填"偏大"、"偏小"、"不变");有同学对乙装置中的缺陷提出三种改进方案。
A方案:将广口瓶中的水改为饱和的CO 2水溶液;B方案:将广口瓶中的水改为氢氧化钠稀溶液;C方案:在广口瓶中的水面上覆盖一层植物油。你认为错误的方案是 (填字母代号);广口瓶内原有的空气对实验结果 (填"有"或"没有")影响;
(3)小宇同学用图丙装置测定CO 2的质量。则图丙实验装置主要存在哪些缺陷?这些缺陷对实验结果有何影响?请写出其中两点主要缺陷及对实验结果的影响。
① ;② 。
有一包白色粉末,可能含有Ba(NO 3) 2、Na 2SO 4、Na 2CO 3、NaNO 3中的一种或几种,为了确定其组成,实验小组设计并进行如表实验:
| 实验步骤 |
实验操作 |
实验现象 |
| 步骤1 |
取样品加入足量水,充分振荡,静置 |
有白色沉淀产生 |
| 步骤2 |
过滤后,往滤渣中加入过量的稀盐酸 |
沉淀全部溶解,并有气体产生 |
(1)实验中产生的气体是 ;
(2)通过探究,得出的结论是 .
现有一包固体粉末,可能由NaOH、Na 2SO 4、Na 2CO 3、BaCl 2、CuSO 4中的一种或几种组成。
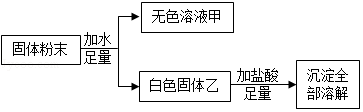
为探究其成分,某化学小组设计并进行了以下实验。(已知:BaCO 3不溶于水,BaSO 4不溶于水也不溶于酸)
(1)固体粉末中一定不含的是 ,一定含有的是 。
(2)为确定该固体粉末中可能含有的物质,还需对溶液甲做进一步探究,请设计简单实验方案。(写出实验操作、现象及结论)
一包固体粉末,可能含有Na 2CO 3、Fe 2(SO 4) 3、NaCl、Na 2SO 4中的一种或几种,为探究其成分,设计以下实验进行探究:
(1)取少许固体粉末于试管中,加水使其充分溶解,得到无色溶液;
(2)取少量(1)中的溶液于试管中,滴加足量的Ba(NO 3) 2溶液,有白色沉淀产生,过滤;
(3)向(2)中的滤渣(白色沉淀)中加入足量的HNO 3,有气泡产生,白色沉淀部分溶解.
【实验结论】:
a、固体粉末中一定不存在 ,一定存在 、 ,可能存在 ;
b、写出(3)中反应的化学方程式 .
在化学课上,老师带来一瓶未知溶液A,已知它是稀盐酸或稀硫酸中的一种,进行如下实验(图1):

观察到烧杯中的现象是(1) 。
【提出问题】A是哪一种酸?
老师要求甲、乙同学从反应后的溶液B分别展开探究。
【猜想假设】甲同学:A是稀盐酸;乙同学:A是稀硫酸。
【实验探究】(如图2)
【评价交流】甲同学的实验(2) (填"能"或"不能")得出正确结论,乙同学的实验(3) (填"能"或"不能")得出正确结论。
实验3发生反应的化学方程式为(4) ,反应后所得溶液中一定含有的离子是(5) 。
【归纳总结】通过乙同学的实验可以得出:选择试剂鉴别溶液中的待测离子时,如果待测溶液中含有干扰离子,则应在鉴别前,先另选试剂将干扰离子变成(6) 除去。经讨论我们能够总结出,除去溶液中干扰离子的一般方法是:选择试剂将干扰离子变成(7) 除去。
某混合气体由CO、CO 2、SO 2三种气体组成,某兴趣小组对此进行了相关实验:
【查阅资料】①SO 2能使品红溶液褪色;②SO 2易与高锰酸钾溶液反应而被吸收,并能使其褪色;③SO 2能使氢氧化钡溶液和澄清石灰水变浑浊;④CO和CO 2均不能使品红溶液褪色,也不与高锰酸钾溶液反应。
【实验研究】为验证这三种气体同学们设计并进行如下实验:

【事实与结论】通过实验验证了以上三种气体都存在。
(1)装置A的作用是 ;
(2)能证明气体中含有CO 2的现象是 ;
【反思与评价】
(3)若装置按C→D→A→B→E的顺序连接,则无法验证的气体是 ;
(4)有同学提出上述原装置中省略D装置也能达到实验目的,你认为该同学的设计有无道理并说明理由 。
小苏打(NaHCO3)和食盐NaCl是厨房中常用物质,现有一包白色固体,可能由NaHCO3和NaCl中的一种或两种组成。某科学小组同学展开了系列拓展性研究。
(一)定性分析
【实验目的】确定白色固体的组成
【实验方案】

【实验结论】该白色固体 由NaHCO3和NaCl两种物质组成
(1)基于上述实验结论,则步骤①中加入的过量稀酸应该是
(2)写出步骤②中生成白色沉淀的化学反应方程式
(二)定量分析
【实验目的】测定该白色固体中NaHCO3的质量分数
为了测定该样品中NaHCO3的质量分数,小吕、小周分别取a克该样品,设计了如下方案:
小吕方案Ⅰ:利用NaHCO3与稀硫酸反应产生CO2,通过测定生成CO2的质量,计算样品中NaHCO3的质量分数
(3)小吕用下列装置完成本实验,装置的连接顺序是 (填装置的字母编号,装置不重复使用);

(4)D装置中的反应完全后,需再次通入空气,其目的是
小周方案Ⅱ:小周用沉淀法测定样品中的NaHCO3的质量分数。操作流程如下:
(已知:NaHCO3+NaOH═Na2CO3+H2O)
(5)为使定量分析更准确,在操作Ⅰ之前,需判断所加BaCl2溶液是否过量,请你设计一个合理方案: 。
某兴趣小组在准备化学实验基本技能考查时,对以下问题进行了探究。
Ⅰ.探究酸和碱能否发生反应
方案l:甲同学向盛有少量NaOH溶液的试管中滴几滴无色酚酞试液,振荡,继续加入稀硫酸,观察到溶液由 色变成无色。甲同学得出结论:酸和碱能发生反应。
方案2:乙同学取少量NaOH溶液,测得溶液pH为10,向该溶液中加入一定量稀硫酸后,测得溶液pH为9,乙同学发现溶液pH减小了,得出结论:酸和碱能发生反应。
交流讨论:大家同意甲同学的结论,对乙同学的实验过程提出质疑,溶液pH减小的原因还可能是稀硫酸中的水稀释了NaOH溶液;大家认为,乙同学向NaOH溶液中加入稀硫酸后,测得溶液的pH必须 7(填“小于”或“小于或等于”)才能证明酸和碱能发生反应。
请写出稀硫酸和氢氧化钠溶液反应的化学方程式 。
Ⅱ.探究酸和碱反应后溶液中溶质的成分
丙同学对探究Ⅰ中甲同学实验后的无色溶液展开探究。
【提出问题】试管中无色溶液的溶质除了酚酞还有什么?
【提出猜想】(l)Na2SO4;(2)Na2SO4和 。
【设计实验】
|
实验操作 |
实验现象 |
实验结论 |
方案1 |
向试管中加入少量锌粒,然后加入甲同学实验后的无色溶液 |
锌粒逐渐减少,有 产生 |
猜想(2)成立 |
方案2 |
向试管中加入少量甲同学实验后的无色溶液,然后慢慢滴加NaOH溶液,并不断振荡试管 |
开始无明显现象,过一会发现 。 |
【实验反思】为了验证猜想(2)成立,你认为还可以选择的药品是 (填字母序号)
A.BaCl2溶液 B.Cu C.Fe2O3。
膨松剂是一种食品添加剂,某研究小组对膨松剂进行了如下探究
【趣味实验】
实验1:和面.向20g面粉中加入10mL水,制得的面团编为1号;向20g面粉中加入10mL水,再加入2g膨松剂M,制得的面团编为2号.
实验2:发面.将和好的2个面团放入微波炉中加热,几分钟后,取出面团,发现1号面团无明显胀大,2号面团明显胀大且手感比较松软.
【提出问题】膨松剂M的成分是什么?
【提出假设】
假设1:M是NH4HCO3;
假设2:M是NaHCO3;
假设3:M是NH4HCO3和NaHCO3
【实验探究1】
序号 |
实验步骤 |
实验现象 |
实验结论 |
① |
取少量M于试管中,加热一段时间 |
无刺激性气味 试管内壁有水珠 试管内有固体剩余 |
假设 成立 假设 不成立 |
【提出新问题】实验①试管中剩余固体是什么?
【实验探究2】
实验②:将实验①所得固体继续加热,无明显现象.冷却,向试管中加水,固体全部溶解,将所得溶液分为2份;向其中1份溶液中滴加稀盐酸,有气泡生成,将生成的气体通入澄清石灰水,有白色沉淀;向另1份溶液中滴加足量氯化钙溶液,有白色沉淀生成,静置,向上层清液中滴加2滴无色酚酞试液,溶液不变红.
【得出结论】
实验①试管中剩余固体是 (填化学式)
【反思提高】
(1)NH4HCO3受热分解的化学方程式是 .
(2)受热稳定性:Na2CO3 (填“>”“=”或“<”)NaHCO3.
【拓展应用】
某品牌复配膨松剂N的配料为:磷酸二氢钙、碳酸氢钠和玉米淀粉,N遇水会发生如下反应:Ca(H2PO4)2+2NaHCO3═CaHPO4↓+Na2HPO4+2CO2↑+2H2O;利用N和面和发面(加热)时,面团都会胀大.下列叙述正确的是 (填序号)
a.常温下的溶解度:Na2HPO4>CaHPO4
b.碳酸氢钠在水溶液中遇到酸性物质能产生气体
c.根据上述反应,产生0.22gCO2至少需要NaHCO3的质量为0.42g.
碳酸钙、碱石灰(NaOH和CaO的混合物)等作为吸收剂可以对燃煤烟气进行脱硫处理,利用数字化实验可以来测定燃煤烟气中SO2的含量,得到如图所示的SO2含量与时间的关系曲线图
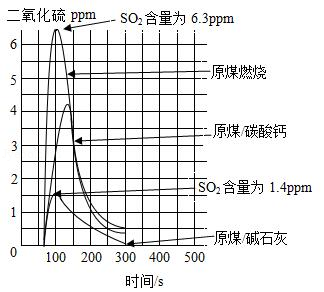
(1)由图可知,脱硫效率较高的吸收剂是 (填名称)。
(2)实验时,称取的3份原煤的质量要相等,其目的是 。
(3)利用碳酸钙吸收SO2转化为CaSO3,CaSO3与空气中O2反应转化为CaSO4.写出CaSO3转化为CaSO4的化学方程式 。
(4)利用碱石灰吸收SO2时,下列措施能使脱硫效率提高的是 (填序号)
a.将原煤与碱石灰粉碎,混合均匀
b.将碱石灰的用量适当增加
c.将时间300s变为500s
(5)利用碱石灰吸收1.28gSO2时,碱石灰中的NaOH、CaO与SO2反应转化为Na2SO3和CaSO3,则理论上反应消耗碱石灰的质量(m)范围是 。
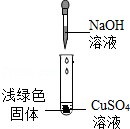
兴趣小组实验中,将NaOH溶液滴入CuSO4溶液中,结果溶液中生成了浅绿色的固体。于是,他们对该浅绿色固体的成分进行探究。
【查阅资料】
①NaOH与CuSO4反应会生产Cu(OH)2,也会生成Cu4(OH)4SO4(碱式硫酸铜)。
②Cu(OH)2在80℃会分解生成CuO。
③Cu4(OH)4SO4不溶于水,能与酸反应,分解温度需300℃。
【猜想与假设】
猜想一:浅绿色固体为Cu(OH)2。
猜想二:浅绿色固体为 。
猜想三:浅绿色固体为Cu(OH)2和Cu4(OH)4SO4。
【获取事实与证据】
①取少量浅绿色固体放入试管中,加热至100℃,观察到黑色固体物质,说明浅绿色固体中存在 。
②另取少量浅绿色固体放入试管中,加入足量稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀,该白色沉淀是 。
【结论】整个实验证明猜想 正确。
试题篮
()