某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式 。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我 (“同意”或“不同意”)小明的观点,因为 。
(3)小红按右图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。

【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
| 实验操作 |
实验现象及结论[ |
| |
|
(4)为了证明镁可在氮气中燃烧生成氮化镁,小红又设计了如下方案进行验证。

步骤①:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、橡皮塞等装配成如图所示的装置;另准备一只有一根铜丝穿过的橡皮塞,铜丝末端固定一根镁条。
步骤②:引燃燃烧匙中足量的红磷,塞好橡皮塞;待充分冷却,观察到广口瓶内水面上升的体积约占瓶内水面原上方空间的 左右。
步骤③:往水槽中加水使广口瓶内外水面相平;点燃镁条,迅速更换橡皮塞,镁条在广口瓶内继续燃烧,放出热量;待冷却后广口瓶内水位继续上升。
A.步骤②的目的是 。写出红磷在氧气中燃烧的化学方程式
B.在步骤③“待冷却后广口瓶内水位继续上升”是由于瓶内气压 (选填“大于” “小于”或“等于”)外界气压
C.写出镁在氮气中燃烧生成氮化镁的化学方程式
【反思与交流】
(5)空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却大于Mg3N2。请给出合理的解释 。
在对蜡烛及其燃烧进行了探究以后,请你填写下列空格:

(1)取一支蜡烛,用小刀切下一小块,把它放入水中,蜡烛会 。结论:石蜡的密度比水 。
(2)点燃蜡烛,观察到蜡烛的火焰分为三层,分别是 、 、 。把一根火柴梗放在蜡烛的火焰上(如右图),约1取出,可以看到在 处(填字母)的火柴梗的最先碳化。结论:蜡烛火焰的 温度最高。
(3)在探究蜡烛燃烧的过程中发现罩在火焰上方的烧杯内壁被熏黑,以下做法不合适是( )
| A.反复实验,并观察是否有相同现象 |
| B.查找资料,了解蜡烛的主要成分,探究生成的黑色固体是什么 |
| C.认为与本次实验无关,不予理睬 |
| D.询问老师或同学,讨论生成黑色物质的原因 |
(4)芳芳认为蜡烛燃烧过程中既有化学变化,也有物理变化,而婷婷认为只有化学变化,你同意_______的观点,理由是_________________
实验是科学探究的重要方法。如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题(提示:铜和氧气反应生成黑色固体氧化铜)。
(1)根据下表提供的实验数据,完成下表:
| 硬质玻璃管中 空气的体积 |
反应前注射器 中空气体积 |
反应后注射器 中气体体积 |
实验测得空气中氧气的体积分数 |
| 25mL |
15mL |
9mL |
_____________ |
(2)若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举两条)__________________,__________________。
(3)装置一和装置二中气球的位置不同,____________(填“装置一”或“装置二”)更合理,理由是____________________。
小明发现双氧水滴在伤口上会产生大量的气泡,于是他查阅了相关资料:双氧水分解可以用二氧化锰(MnO2)、氧化铁(Fe2O3)等物质作催化剂,对此他展开了探究。
【提出问题】氧化铁是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】小明以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)
| 实验序号 |
氯酸钾质量 |
其他物质质量 |
待测数据 |
| ① |
1.2g |
/ |
|
| ② |
1.2g |
Fe2O3 0.5g |
|
| ③ |
1.2g |
MnO2 0.5g |
|
①上述实验应测量的“待测数据”是 。
②若实验②比实验①的“待测数据”更 (填“大”或“小”),说明氧化铁能加快氯酸钾的分解。
③将实验②反应剩余的固体取出后经洗涤、干燥,再次精确称量得到0.5g红色粉末(Fe2O3),这样做的目的是 ,小明同学认为氧化铁肯定是氯酸钾分解的催化剂,但晓航同学对此提出了异议,晓航同学设计了如下实验:
将第二次精确称量得到的0.5g红色粉末和1.2g氯酸钾混合放入试管中,加热,伸入带火星木条,发现木条很快复燃。
晓航同学这样做目的是 ,
【预期结论】氧化铁也能作氯酸钾的催化剂。
【评价设计】你认为小明设计实验③和实验②对比的目的是 ;
写出实验②反应的符号表达式 。
小明和小红对市场上销售的一种真空充气包装的形如小枕头“蛋黄派”发生了兴趣,如下图所示.他们查阅资料获知:这种真空充气包装技术,即将食品装入包装袋,抽出包装袋内空气,再充入某种气体,然后封口.它能使食品保持原有的色、香、味及营养价值,防止食品受压而破碎变形.那么,这是什么气体呢?小红猜想是氮气,小明猜想是二氧化碳.
请你帮助他们设计一个简单的实验方案,来判断小明的猜想是否正确,简要写出操作步骤(方法、现象和结论):
| 实验步骤 |
现象 |
结论 |
| 用注射器抽取袋内气体,然后通入澄清的石灰水。 |
|
|
化学教材 “寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【提出问题】(1)氧化铁能否作过氧化氢溶液分解的催化剂?
(2)氧化铁与二氧化锰催化效果哪个好?
【实验探究】
| 实验步骤 |
实验现象 |
| ①分别量取5 mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入a g氧化铁粉末,并分别在A、B两支试管中插入带火星的木条,观察现象。 |
A试管中产生大量气泡,带火星木条复燃,B试管中的现象 |
| ②待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管内,如此反复多次实验,观察现象。 |
试管中均产生大量气泡,带火星木条均复燃 |
| ③将实验②中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为a g。 |
|
| ④分别量取5 mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入a g氧化铁粉末,向D试管中加入a g二氧化锰粉末,观察现象。 |
 |
(1)A中产生的气体是 ;B试管中的现象 。
(2)实验②、③证明:氧化铁的 和 在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的文字表达式 。
(4)实验设计④的目的是 ,若实验④观察到D试管中产生气泡的速率更快,由此你可以得到的结论是 。
小雨阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣。
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
查阅资料:氯酸钾、氯化钾等固体可以溶解于水,二氧化锰、氧化铜等固体不溶于水。
【设计实验】小雨以生成100毫升的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
| 实验序号 |
氯酸钾质量 |
其它物质质量 |
待测数据 |
| ① |
1.5g |
|
|
| ② |
1.5g |
CuO 0.5g |
|
| ③ |
1.5g |
MnO2 0.5g |
|
(1)上述实验应测量的 “待测数据”是 ;
(2)若实验②比实验①的“待测数据”更 (填“大”或“小”),说明 氧化铜能加快氯酸钾的分解速率。
(3)将实验②反应后的固体进行加水溶解、 (填操作名称)、洗涤干燥、称量等步骤后,得到黑色粉末0.5g。
(4)将步骤(3)得到的黑色粉末放入另一试管中,向试管中倒入适量的双氧水(重复多次此实验),观察到试管中均能迅速产生大量气泡。
试写出该反应的符号表达式 。
【预期结论】综合以上步骤(2)(3)(4)可得出氧化铜能作氯酸钾的催化剂。
【评价设计】你认为小雨设计实验③和实验②对比的目的是 。
研究和控制化学反应条件有重要意义。
(1)同学们想探究双氧水的浓度对反应速率的影响。在其他条件相同的情况下进行了三次实验,记录各收集一瓶相同体积氧气所需要的时间。
| 实验 |
双氧水的质量(g) |
双氧水浓度(%) |
二氧化锰质量(g) |
收集时间(s) |
| 1 |
50 |
6 |
5 |
200 |
| 2 |
50 |
12 |
5 |
100 |
| 3 |
50 |
18 |
______ |
67 |
①写出上述反应的文字表达式________________________。
②实验3中,加入的二氧化锰质量为___________g。
③相同条件下,实验3产生氧气的速率最快,说明________________________。
④同学通过查阅资料得知,双氧水在70℃以上会较快分解产生氧气。
为了验证加热双氧水也可以产生氧气,同学们选择右图装置(气密性良好)进行实验。实验中观察到试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是________________,同学分析原因后,采用了____________法收集气体,再检验,证明加热双氧水也可产生氧气。
研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】过氧化氢生成氧气的快慢与催化剂种类有关
【实验方案】常温下,在两瓶体积相同、浓度相同的过氧化氢溶液中分别加入相同质量的二氧化锰和红砖粉,测量各生成一瓶(相同体积)氧气所需要的时间。
【进行实验】图示是他们进行实验的装置图,气体发生装置中A仪器的名称是:_________,此实验中B处宜采用的气体收集方法是_____________。
【实验记录】
| 实验编号 |
1 |
2 |
| 反应物 |
6% 过氧化氢 |
6% 过氧化氢 |
| 催化剂 |
1 g红砖粉 |
1 g 二氧化锰 |
| 时间 |
152 s |
35 s |
【结论】该探究过程得出的结论_____________________。
【反思】过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉后反应明显加快。若要证明二氧化锰和红砖粉是否是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的___________和_________是否变。
过氧化氢生成氧气的快慢还与哪些因素有关?请你帮助他们继续探究。(只要求提出假设和实验方案)
同学们探究“影响实验室用过氧化氢溶液制取氧气反应速率的因素”,过程如下:
(1)对已有化学知识和生活经验的思考:
| 化学知识和生活经验 |
思考 |
| 木炭在氧气中燃烧比在空气中更旺 |
双氧水的浓度可能会影响生成氧气的快慢 |
| 夏天,将食品放在冰箱里不容易腐烂 |
(8) |
(2)根据上述思考设计了如下实验:
| 组别 |
温度 |
二氧化锰的质量 |
双氧水的浓度和体积 |
观察产生气泡的速率 |
| 1 |
室温 |
0.5g |
5%、50 mL |
反应平稳,有大量气泡产生 |
| 2 |
加热 |
0.5g |
w%、50 mL |
气泡急速产生,并产生大量白雾 |
| 3 |
室温 |
0.5g |
30%、50 mL |
气泡呈爆发式产生,并带出反应液 |
① 实验2中双氧水的浓度(w %)以 (9) 为宜。
② 通过比较 (10) 两组实验,可③以得到“浓度越大,化学反应越快”的结论。
③ 实验结论:第 (11) 组方案比较适合在实验室制取氧气。
④ 通过分析思考,影响化学反应速率的因素可能还有 (12) 。(写出一条)
小明和小红对市场上销售的一种分袋包装的蛋糕发生了兴趣,包装蛋糕的塑料袋被气体充得鼓鼓的,看上去好像一个小“枕头”。他们认为这种包装技术,主要是为了延长蛋糕的保质期,同时避免蛋糕被压变形。那么,这是什么气体呢?小红猜想是氮气,小明猜想是二氧化碳。
(1)请你帮助他们设计一个简单的实验方案,来判断小明的猜想是否正确,简要写出实验步骤: 。
(2)小明的猜想如果正确,现象应是 。
(3)你认为食品充气包装,对所充气体的要求是① ② 。
铜是一种常用的金属,纯净的铜颜色为紫红色,它能够和硝酸银溶液发生化学反应,生成硝酸铜和银单质。某同学设计下表所示实验,探究金属铜对过氧化氢溶液分解速率的影响。
| 操作 |
装置 |
现象 |
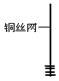
| 1、取一小块铜丝网,卷成筒形,固定在铜丝上。 |
 |
 |
| 2、分别向①和②中注入15mL、30%的H2O2,并放入盛有热水的③中。 |
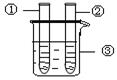 |
约1min后可观察到①和②中都有少量气泡产生 |
| 3、把铜丝插入①中。 |
 |
①中有大量气泡产生,约5min后不再有气泡产生;此时②中仍然有少量气泡产生 |
(1)仪器②中实验的目的是__________________________;
(2)根据上述实验,可以得出的结论是______________________________;
(3)如果用本实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是___________________。
A.称量实验前铜丝网的质量 B.将实验后的铜丝网干燥、称重
C.向仪器中加入二氧化锰 D.将实验后的铜丝网插入AgNO3溶液中。
某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
一、为探究催化剂的种类对双氧水分解速度的影响,甲设计以下对比实验:
Ⅰ.将3.0g 10%过氧化氢溶液与1.0g MnO2均匀混合
Ⅱ.将x g10% H2O2溶液与1.0g CuO均匀混合
在相同温度下,比较两组实验产生O2的快慢。
(1)为了Ⅰ与Ⅱ中对比x的值应为 。
(2)甲选用下列装置测量产生O2的快慢,正确的是 (填编号)。

二、探究影响双氧水分解速度的某种因素。实验数据记录如下(常温通常指20℃)
| 实验 |
温度 |
药品 |
氧气体积/ml |
反应所需时间/s |
|
| ① |
常 温 |
5% H2O2 |
|
0 |
|
| 常 温 |
5% H2O2 |
MnO2 |
125 |
20 |
|
| ② |
常 温 |
5% H2O2 |
MnO2 |
125 |
20 |
| 热水中 |
5% H2O2 |
MnO2 |
125 |
18 |
|
| ③ |
常 温 |
5% H2O2 |
MnO2 |
125 |
20 |
| 常 温 |
30% H2O2 |
MnO2 |
125 |
5 |
(1)通过实验①对比可知,化学反应快慢与 有关。
(2)通过对比实验 可知,反应物浓度大,反应速率快。
(3)除了上述的两个因素能影响化学反应快慢,你认为另一个影响因素是 ,其关系是 。
(4)由上述实验可知温度、浓度、催化剂等都是影响化学反应速率,实验室用过氧化氢制取氧气的最合适的条件是 。
某小组同学进行了有关蜡烛成分测定的实验
| 实验步骤 |
现象 |
结论 |
|
 |
在蜡烛火焰上方罩一个冷而干燥的烧杯 |
烧杯内壁有小液滴 |
产物中有 |
| 将内壁涂有 的烧杯罩在火焰上方 |
|
产物中有二氧化碳 |
由此可知:蜡烛的成分主要由 元素组成,可能还含有 。
为了探究分子的运动性,小强进行下面的实验:
步骤一:如下图所示:

问题:Ⅰ:实验(3)中,滤纸条的变化情况是: 。
Ⅱ:分析上面三个实验的现象,简单解释滤纸变红的原因? 。
步骤二:小强用剪刀在滤纸上剪取一条长滤纸,并在滤纸条上间隔地滴入酚酞溶液,然后放进试管里。最后用蘸有浓氨水的棉花团塞住试管(如右图所示),观察现象。

问题:Ⅰ:上面实验观察到的现象是 ,说明分子 。
Ⅱ:该实验还说明浓氨水的物理性质有 。
反思与交流:
(1)步骤一在整个探究实验中所起的作用是 ,三个实验中没必要做的实验是 。
(2)有人说:“在实验步骤一中,要获得‘酚酞遇氨水变红’这个结论不是很严密,因为滤纸变红,有可能跟滤纸中某种化学成分有关。具体地说,有可能是酚酞跟氨水作用,生成的某种物质再跟滤纸中的该种化学成分发生作用而使滤纸变红。”
你同意上面说法吗?答: 。为了验证他(她)的说法,你补做的实验是(请简单写出实验过程) 。
试题篮
()