化学兴趣小组利用废烧碱(含少量Na2CO3、NaCl、MgCl2、CaCl2等)制Na2CO3·10H2O。
【制取流程】
【相关资料】①Na2CO3+H2O+CO2=2NaHCO3 ②2NaHCO3 Na2CO3+H2O+CO2↑
②2NaHCO3 Na2CO3+H2O+CO2↑
③在NaHCO3溶液中加入BaCl2溶液,可发生如下反应:
2NaHCO3+BaCl2=BaCO3↓+2NaCl+ H2O+CO2↑
④碳酸钠的饱和溶液在不同温度下析出的晶体如下图所示:
【问题讨论】
(1)滤渣主要成分为Mg(OH)2和 ,产生Mg(OH)2的化学方程式 。
(2)操作Ⅰ需使用的玻璃仪器有:烧杯、 和玻璃棒。
(3)取少量溶液B,加入BaCl2溶液,充分混合,若观察到 (填现象),则溶液B中含NaHCO3。
(4)结晶后,过滤时的温度须低于 ℃。
(5)“母液”不能沿流程中虚线路径循环使用,原因是 (选填序号)。
①“母液”不含Na2CO3 ② “母液”多次循环后,NaCl含量增加
【组成确定】
(6)取少量的粗产品,加水溶解,加足量 (选取数字序号,下同),充分搅拌,再加少量 ,无沉淀,证明其中不含NaCl。
①AgNO3溶液 ②稀盐酸 ③稀硝酸
(7)兴趣小组同学取32.8g干燥粗产品,用如图所示装置(夹持仪器省略)进行实验
查阅资料1:Na2CO3·10H2O加热至32℃,开始分解失水,充分加热可以完全失水;
NaHCO350℃时开始分解,270℃完全分解,Na2CO3受热不分解
查阅资料2:Ba(OH)2溶液能吸收CO2,Ba(OH)2+CO2=BaCO3↓+H2O
①实验前先要 ,再装入粗产品,装置A的作用是 。
②粗产品加热至270℃,据 (填装置编号及现象),可知粗产品中含 。
某同学做了以下两个实验。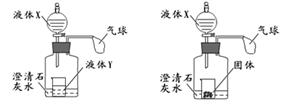
实验1 实验2
(1)实验1中,若液体X为稀盐酸。向盛有液体Y的烧杯中滴入适量液体X,液体Y中有气泡产生,一段时间后澄清石灰水变浑浊,气球鼓起,液体Y可能为 。实验后取下胶塞将烧杯取出,塞紧胶塞再向瓶内滴加适量盐酸,观察到的现象有
,原因是 。
(2)实验2中,若液体X为水,将其滴入盛有固体的烧杯中,一段时间后澄清石灰水变浑浊,固体可能为 ,石灰水变浑浊的原因是 。若将瓶中浑浊的液体变澄清,可采取的方法有
(至少写出三种)。
A、B、C是初中化学常见的液体、气体、固体,气球套在试管口且保证密封性能良好。
(1)若A能使紫色石蕊变红,B为空气,将固体C倒入试管中产生气泡,同时气球因膨胀而鼓起来。液体A,固体C可能是什么物质?请给出两种不同组合(C为不同类别物质),组合一:_________,化学方程式 ;组合二:________,化学方程式_________。
(2)若 A是水,将气球中的固体C倒入试管中,气球很快被吸入试管中,气体B是________,固体C是________。
现有生活中常见的四种未知白色粉末,它们分别是食盐、纯碱、去污粉(主要成分为碳酸钠和碳酸钙)和使用过的生石灰干燥剂。化学小组为了确定每种未知固体的成分,将它们分别标记为①、②、③、④后进行实验,实验现象记录如下:
| 实验过程 |
实验现象 |
| 实验1: 分别取样于四支试管中,加入足量的水充分溶解 |
②、③ 完全溶解,①、④ 均在试管底部有白色固体,且①中有明显放热 |
| 实验2:静置一段时间后,分别取上层清液,加入试剂A |
③、④均有气泡产生 |
| 实验3:分别取样于四支试管中,加入足量试剂A |
白色固体均消失;①③④均有气泡产生 |
根据以上实验现象,回答下列问题:
(1)实验1中,物质①发生反应的化学方程式是 。
(2)物质②为 ,试剂A为 。
(3)实验3中,试剂A与物质④发生反应的化学方程式是 。
(4)通过实验判断,物质①中一定含有的成分是 。
A、B、C、D为初中化学常见的物质,它们之间存在一定的关系,请根据下列叙述回答问题。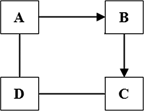
(1)若A为红色固体,C为难溶于水的白色固体,且D能转化为B,则A与D反应的化学方程式为 ,A→B的方程式为 。
(2)若A 为难溶于水的白色固体,且D能转化为B ,C与D反应有气体产生,则C的化学式为 ,D→B反应的化学方程式为 。
(3)若A在空气中易形成致密的氧化膜,且A能转化为C,B与D可相互反应,所有的反应均为置换反应,则B的化学式为 ,C与D反应的化学方程式为 。
"钾泻盐"的化学式为
,是一种制取钾肥的重要原料,它溶于水得到
与
的混合溶液。某化学活动小组为了测定"钾泻盐"中
的质量分数,设计了如下两种实验方案:
方案一:

方案二:

试回答下列问题:
(1)你认为方案比较合理,理由是。
(2)请选择上述方案中的数据,计算
钾泻盐样品中
的质量。(写出计算过程)。
(3)请选择上述方案中的数据,计算
钾泻盐样品中
的质量分数。(写出计算过程)。
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。
(1)配制200
质量分数为8%的氢氧化钠溶液。
①计算:需要氢氧化钠固体的质量为
,水的体积为
(水的密度近似看作
)。
②称量:调节托盘天平平衡,将一个烧杯放在托盘天平的盘,称量其质量。然后(按操作的先后顺序选填字母),直至天平平衡。
| A. |
将氢氧化钠固体加入烧杯中 |
B. |
按需要添加砝码、移动游码 |
该步骤中用烧杯而不用纸称量氢氧化钠的原因是.
③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温。
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签。
(2)右图表示用上述配制的氢氧化钠溶液与20
某稀盐酸发生反应后溶液温度的变化情况。
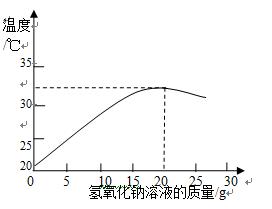
①根据曲线判断,当加入氢氧化钠溶液的质量为时,反应恰好完全进行。
②当加入15
氢氧化钠溶液时,所得溶液中的溶质为(写化学式)。
③试计算该稀盐酸中溶质的质量分数(请写出计算过程)。
试题篮
()