碱式碳酸锌[Zn x(OH) y(CO 3) z]是制备功能材料ZnO的原料,其化学反应表达式为:Zn x(OH) y(CO 3) z  ZnO+CO 2↑+H 2O(x、y、z为正整数)。小金设计了图甲所示装置对碱式碳酸锌的组成进行探究(装置气密性良好,药品足量,实验操作正确):
ZnO+CO 2↑+H 2O(x、y、z为正整数)。小金设计了图甲所示装置对碱式碳酸锌的组成进行探究(装置气密性良好,药品足量,实验操作正确):
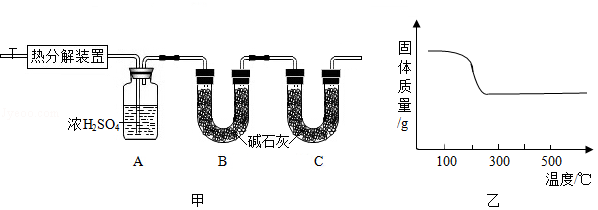
(1)图甲中装置B的作用是 。
(2)查阅资料发现,在不同温度条件下充分加热等质量的碱式碳酸锌样品,剩余固体的质量与加热温度的关系如图乙所示。实验中加热时,热分解装置的温度至少要达到 ℃(选填"200"、"300"或"400")。
(3)部分实验步骤为:"……加热前先通入N 2排尽装置内的空气,关闭通入N 2的活塞,……控制一定温度下加热……"。实验过程中可根据 现象判断碱式碳酸锌样品已反应完全。
(4)小金取54.7g碱式碳酸锌样品(不含杂质),放置于热分解装置内,完全反应后测得装置A增重5.4g,装置B增重8.8g。则x:y:z的最简整数比为 。
有一包白色固体可能含氯化钠、碳酸钙、硝酸铵、氯化钡和硫酸钠中的一种或几种,实验小组设计如下实验方案,检验白色固体的成分(假设实验中每一步均恰好完全反应)。
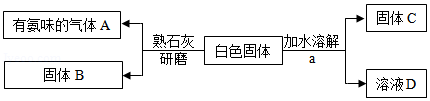
回答下列问题:
(1)a处的操作是 。
(2)气体A的化学式是 。
(3)硝酸铵在农业上常用作 肥。
(4)若固体C中加入稀硝酸,有一部分溶解则原粉末的成分中一定有 。
(5)若固体C中加入稀硝酸,固体不溶解,写出生成固体C的化学反应方程式 ,化学反应基本类型为 。
某腐蚀印刷电路板的废液经处理后只含有CuCl2和FeCl2两种溶质,为了分析处理后废液的组成,取200g该废液加入40g废铁屑(杂质不溶于水,也不参与反应),恰好完全反应,过滤经处理得到16g铜,往滤液中加入足量的硝酸银溶液,经过滤、干燥、称量,最终得到114.8gAgCl固体.回答下列问题:
(1)往废液中加入废铁屑发生反应的化学方程式为 ,
往滤液中加入硝酸银溶液发生反应的化学方程式为 .
(2)求滤液中溶质的质量分数(精确到1%).
(3)求200g废液中FeCl2的质量分数(精确到1%).
将过量的
溶液滴入到一定量
溶液中得到蓝色固体。某研究性学习
小组对蓝色固体的成分进行了如下探究。请完成下列各题:
(一)猜想与假设:
猜想一:固体为
,理由:(用化学反应方程式表示)。
猜想二:固体为
,理由:
溶液呈(填"酸"或"碱")性。
猜想三:固体为
和
的混合物。
(二)资料查阅:
①
和
晶体均不带结晶水;
②
、
受热易分解,各生成对应的两种氧化物。
(三)设计与实验:
Ⅰ.固体的获取:
(1)将反应后的固、液混合物经、洗涤、低温烘干得蓝色固体。
(2)判断固体已洗净的方法及现象。
Ⅱ.用下图所示装置,定性探究固体的成分。

(3)若用装置
、
组合进行实验,
中无现象,则猜想正确;
(4)若用装置
、
组合进行实验,
中无现象,则猜想正确;
(5)小组同学将装置按
、、(填"
"、"
")的顺序组合进行实验,验证出猜想三是正确的,实验中:
中的现象为,
中的现象为。结论:固体为
和
的混合物。
Ⅲ.固体成分定量测定:
已知
的分解温度为
,
的分解温度为
。设固体的组成为
。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如右图,请根据图示回答下列问题:

(6)写出
、
段发生反应的化学方程式:
段:;
段:;
(7)通过计算可得:
。
(8)若将
剩余固体继续加热到更高的温度,发现固体质量减少了
后质量不再改变,写出此过程中可能发生反应的化学方程式:。
试题篮
()