硝酸钾和氯化铵的溶解度曲线如图1所示。某化学兴趣小组的同学进行了如图2所示实验,R是硝酸钾、氯化铵中的一种物质。
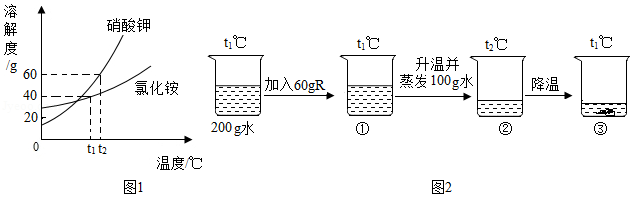
(1)硝酸钾和氯化铵两种物质的溶解度均随温度的升高而 。
(2)由图1可知:t 1℃时,氯化铵饱和溶液中溶质与溶液的质量比为 。
(3)结合图1和图2判断:烧杯内的物质R是 。①、②、③三种情况下,一定是饱和溶液的有 (填序号)。
请根据如图甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
(1)在 ℃时,甲、丙两种物质的溶解度相等;
(2)在t2℃时,向盛有25g甲物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数为 。
(3)若乙物质中混有少量甲物质,最好采用 (填“降温结晶”或“蒸发结晶”)的方法提纯乙;
(4)t2℃时,甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是 。

甲、乙两种物质的溶解度曲线如图。
(1)A点的含义是 。
(2)t2℃时,甲、乙两种固体各8g分别投入25g水中,充分搅拌。
① (填“甲”或“乙”)所得溶液为不饱和溶液,若保持温度不变,加入溶质 g可使其达到饱和。
②乙所得溶液中溶质质量分数为 %。

硝酸钾的溶解度曲线如图所示。下列说法正确的是( )

A.氢氧化钙的溶解度曲线与硝酸钾相似
B.A、B、C三点对应的溶液均为饱和溶液
C.溶质的质量分数:A>B>C
D.从硝酸钾溶液中获得晶体的方法:蒸发浓缩、冷却结晶
如图是A、B、C三种固体物质(均不含结晶水)的溶解度曲线。请回答下列问题:
(1)在 ℃时,A、C的溶解度相同。
(2)A中混有少量B,提纯A的方法是 结晶。

KNO3和KCl在不同温度时的溶解度如下表所示:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
KCl |
27.6 |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
48.3 |
回答下列问题:
(1)20℃时,KCl的溶解度为 g。
(2)依据表中数据,绘制KNO3和KCl的溶解度曲线,如图中能表示KCl溶解度曲线的是 (选填“a”或“b”)。
(3)20℃时,向10g水中加入2.5g KNO3充分搅拌得到X,再加入2.5g KNO3充分搅拌得到Y,继续升温至50℃得到Z,则X、Y、Z中为饱和溶液的是 。
(4)40℃时,现有质量均为100g的硝酸钾和氯化钾两种饱和溶液,若将它们同时降温至10℃.下列说法正确的是 。
A.40℃时,硝酸钾饱和溶液中水的质量大于氯化钾饱和溶液中水的质量
B.降温至10℃时,析出的KNO3晶体质量比析出的KCl晶体质量大
C.降温至10℃时,硝酸钾饱和溶液的质量分数大于氯化钾饱和溶液的质量分数
D.当温度降至20℃和30℃之间的某一温度,两种溶液的质量分数可能相等

如图是NaCl和KNO3在不同温度下的溶解度曲线,根据曲线回答下列问题。
(1)t℃时,饱和NaCl溶液与饱和KNO3溶液的溶质质量分数 (填“相同”、“不同”或“无法确定”)。
(2)40℃时,相同质量的饱和NaCl溶液与饱和KNO3溶液均降温至20℃,析出晶体质量较多的是 。

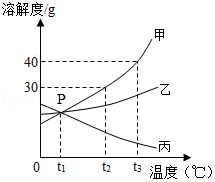
如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题。
(1)P点表示在温度为t1℃时,三种物质的溶解度 。
(2)t2℃时,在温度不变的情况下要将丙的不饱和溶液变成饱和溶液的方法是 (任写一种)。
(3)t2℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,所得溶液的质量是 g。
(4)t3℃时,三种物质的溶解度由大到小的顺序为 。
(5)将t3℃时丙的饱和溶液降温到t2℃,溶液中溶质的质量分数 (填“变大”、“变小”或“不变”)。
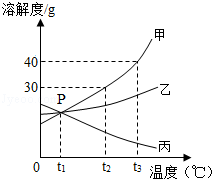
如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题。
(1)P点表示在温度为t1℃时,三种物质的溶解度 。
(2)t2℃时,在温度不变的情况下要将丙的不饱和溶液变成饱和溶液的方法是 (任写一种)。
(3)t2℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,所得溶液的质量是 g。
(4)t3℃时,三种物质的溶解度由大到小的顺序为 。
(5)将t3℃时丙的饱和溶液降温到t2℃,溶液中溶质的质量分数 (填“变大”、“变小”或“不变”)。
盐湖地区人们常采用“夏天晒盐,冬天捞碱”的方法来获取NaCl和Na2CO3.结合溶解度曲线判断,下 列说法错误的是( )

A.NaCl的溶解度随温度变化不大
B.44℃时Na2CO3饱和溶液的质量分数为50%
C.“夏天晒盐”的原理是让湖水蒸发结晶得到NaCl
D.“冬天捞碱”的原理是让湖水降温结晶得到Na2CO3
如图是甲、乙、丙三种固体物质在水中的溶解度曲线。下列说法正确的是( )
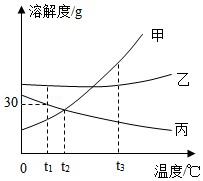
A.t1℃时丙的饱和溶液升温到t3℃变为不饱和溶液
B.t2℃时,甲、丙两种物质的溶解度相等
C.甲中混有少量的乙,可采用蒸发结晶的方法提纯甲
D.t1℃时将20克丙物质溶于50克水中,得到70克溶液
甲、乙、丙三种物质(均不含结晶水)的溶解度曲线如图所示,回答下列问题:
(1)t1℃时P点的意义是 。
(2)t2℃时,比较甲、丙两物质的饱和溶液的溶质质量分数为:甲 丙(选填“>”、“=”或“<”)。
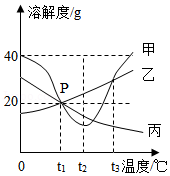
甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,如图所示,下列说法正确的是( )

A.三种物质的溶解度都随温度的升高而增大
B.P点表示t2℃时甲、丙两物质的溶解度相等
C.t1℃时,乙物质的饱和溶液溶质质量分数为30%
D.甲中含有少量乙,可采用蒸发结晶的方法提纯甲
如图是a、b、c三种固体物质的溶解度曲线图,请判断下列说法,其中正确的是( )
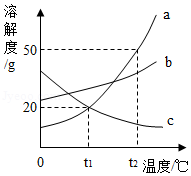
A.使a、c的饱和溶液析出晶体的方法都可以是降温结晶
B.t1℃时,a、c两种物质的溶液的溶质质量分数一定相等
C.在t2℃时,将a物质30g加入50g水中,充分溶解,所得溶液质量为80g
D.t2℃时,a、b、c三种物质的饱和溶液的溶质质量分数由大到小的关系是:a>b>c
试题篮
()