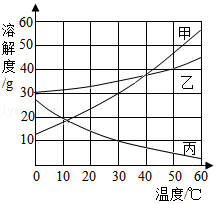
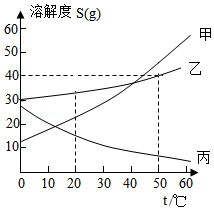
如图为甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。
①20℃时,甲、乙、丙的溶解度由大到小的顺序是 。
②30℃时,50g水中加入10g固体丙,充分溶解后,所得溶液的质量为 g;
③60℃时,将等质量的甲、乙、丙三种固体分别溶于水中,都恰好配制成饱和溶液,所得甲、乙、丙的三种饱和溶液的质量由大到小的顺序为 。
甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
A.乙的饱和溶液升温后溶质的质量分数会变大
B.仅用降温至0℃的方法可将a点的甲溶液转化为饱和溶液
C.t2℃时等质量的甲、乙饱和溶液中溶剂质量:甲<乙
D.除去甲中混有的少量乙宜采用的结晶方法是

某兴趣小组制取氧气,并尝试回收部分药品。可能用到的部分装置如图1。

(1)如图1中仪器a的名称是 。
(2)用双氧水和MnO2制氧气。发生反应的化学方程式为 ,收集氧气的装置可选用 (填字母)。
(3)加热KClO3固体制氧气(1.5g MnO2作催化剂),并对KClO3完全分解后的残留固体进行分离。(已知反应原理为:2KClO3 2KCl+3O2↑)
①发生装置应选用 (填字母)。
②KCl的溶解度曲线如图2所示。将残留固体冷却至室温(20℃),称得其质量为4.8g。欲将KCl全部溶解。至少应加入该温度下蒸馏水的体积约 (填字母)。

a.5mL
b.10mL
c.20mL
d.30mL
③对溶解所得混合物进行过滤,滤渣经处理得MnO2,从滤液中获得KCl晶体的最佳方法是 。
中国古代四大发明之一的"黑火药"是由木炭(C)、硫粉(S)和硝酸钾(KNO 3)按一定比例混合而成。
(1)分类。下列关于"黑火药"说法正确的是 。
a."黑火药"由"黑火药分子"构成
b."黑火药"中的KNO 3属于复合肥料
c."黑火药"中的C、S不再保持各自的化学性质
(2)变化。"黑火药"爆炸时发生的主要反应是:S+2KNO 3+3C═K 2S+N 2↑+3 ↑。
①依据质量守恒定律,空格上缺少的物质是 (填化学式)。
②"黑火药"爆炸时能闻到刺鼻的火药味,是因为爆炸时除了有硫化物,还有硫的氧化物生成。硫在空气中燃烧的化学方程式为 。
(3)制备。古代曾用硝土(含有Ca(NO 3) 2、少量NaCl等)和草木灰(含有K 2CO 3)作原料制取KNO 3.某化学兴趣小组设计了如图实验流程:
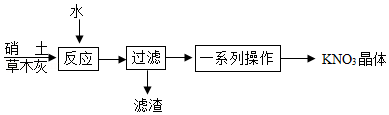
①"反应"过程中的化学方程式为 。
②"过滤"操作必须用到的玻璃仪器有烧杯、玻璃棒和 。
③如图是硝酸钾和氯化钠的溶解度曲线。"一系列操作"包括"加热蒸发浓缩、再冷却到一定温度、过滤"等步骤。其中"冷却到一定温度"能获得纯度较高的硝酸钾晶体的原因是 。
(4)发展。现代国防、开矿等使用的烈性炸药,主要成分为硝化甘油(C 3H 5O 9N 3)。
①硝化甘油在人体内能缓慢氧化生成一种氮的氧化物,用于治疗心绞痛。该氧化物中氮为+2价,其化学式为 。
合成硝化甘油的化学方程式为C 3H 8O 3+3HNO 3═C 3H 5O 9N 3+3H 2O.现用46kg甘油(C 3H 8O 3)和足量硝酸反应,理论上能生成多少硝化甘油?(写出计算过程)
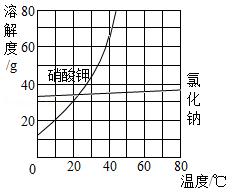
如图是硝酸钾(KNO3)和氯化钾(KCl)的溶解度曲线,请回答下列问题。
(1)10℃时,KNO3和KCl的溶解度大小关系是:KNO3 KCl(填“>”“<”或“=”)。
(2)60℃时,将120g KNO3固体放入100g水中,充分溶解后,所得溶液的质量为 g。
(3)KNO3中混有少量的KCl,可用 的方法提纯KNO3。
(4)据图,下列有关说法正确的是 。
A.KCl的不饱和溶液只能采用蒸发溶剂的方法才可变成饱和溶液
B.60℃时,KNO3溶液的溶质质量分数一定比KCl溶液的大
C.将60℃时KNO3和KCl两种溶液分别降温至10℃,析出晶体较多的是KNO3溶液
D.60℃时,从KNO3和KCl两种饱和溶液中获得等质量晶体,蒸发水较多的是KCl溶液

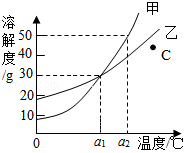
如图为甲、乙两种物质(均不含结晶水)的溶解度曲线。据此回答下列问题:
(1)当温度为 ℃时,甲、乙两种物质的溶解度相等。
(2)图中C点对应的乙溶液是 (填“饱和”或“不饱和”)溶液。
(3)当温度为a2℃时,在100g水中加入60g甲,溶液中溶质的质量分数为 (结果保留三位有效数字)。
数据处理是对数据进行加工的过程,列表法和作图法是常用的数据处理方法。请你根据图表分析:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度/g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
|
表:两种物质在不同温度时的溶解度
(1)KNO3对应的是图中的 物质。
(2)25℃时,向100g水中加入45.8g KNO3,充分搅拌后,所得的溶液是 溶液(填“饱和”或“不饱和”)。
(3)当甲中含有少量乙时,应采用 结晶法提纯甲。

水是生命之源,是人类生产、生活中不可缺少的物质。
(1)初中化学实验中经常用到水。下列实验有关水的用途叙述正确的是 (填写所有正确的序号)。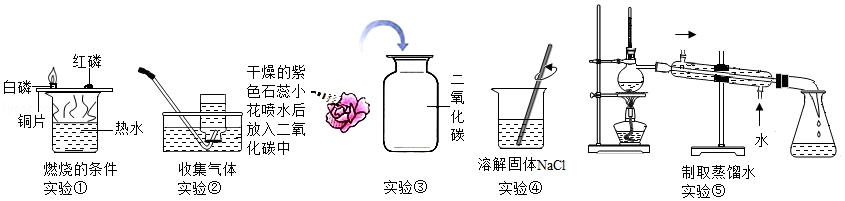
A.实验①中热水对铜片起到了加热的作用
B.实验②中主要利用了气体密度比水小
C.实验③④中水只是一种溶剂,没有参加反应
D.实验⑤中水起到冷凝的作用
(2)某同学在课外实验中,自制简易净水器用到了活性炭,这是利用了活性炭的 作用。
(3)水常用作物质溶解的溶剂,KNO3与NH4Cl在水中的溶解度曲线如图一所示,请回答:
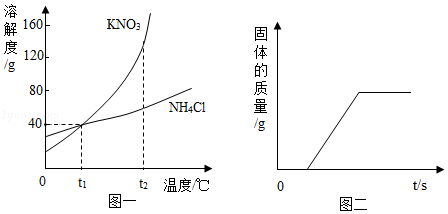
①在t1℃时,KNO3与NH4Cl的溶解度均为 ;
②在t2℃时,将80g X物质加入到100g水中,充分溶解后降温至t1℃,溶液中析出固体质量的变化如图二所示,则X为 (填“KNO3”或“NH4Cl”);
③取t2℃时KNO3、NH4Cl饱和溶液各100g,分别降温至t1℃,所得溶液中溶质的质量分数的关系为:KNO3 NH4Cl(填“>”、“<”或“=”)。
根据NaCl和KNO3的溶解度曲线图回答下列问题。
(1)50℃时,KNO3的溶解度是 g;
(2)NaCl和KNO3的溶解度受温度影响较大的是 (填化学式);
(3)20℃时,将20g NaCl加入50g水中,充分溶解后,所得溶液的质量是 g;
(4)将20℃时的NaCl和KNO3饱和溶液分别升温至50℃,所得溶液溶质的质量分数大小关系是:NaCl KNO3(填“>”、“=”或“<”)。

甲、乙、丙三种固体物质的溶解度曲线如图所示:
(1)20℃时,甲、乙、丙三种固体物质的溶解度由大到小的顺序是 。
(2)10℃时,将甲、乙、丙各100克饱和溶液升温到40℃,有溶质析出的是 (填字母代号)。
A.甲
B.乙
C.丙
(3)50℃时,20g乙物质溶于水制成饱和溶液,所得溶液中溶质的质量分数为 (结果保留一位小数)。
(4)若甲物质溶液中混有少量的乙物质,提纯甲物质可采用的方法是 (填字母代号)。
A.过滤
B.结晶
C.蒸馏
甲、乙、丙三种固体物质的溶解度曲线如图1所示,请回答下列问题:

(1)t1℃时,甲、乙、丙三种物质中溶解度最大的是 。
(2)t2℃时,甲物质的溶解度为 g。
(3)将t2℃时的甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液溶质质量分数由大到小的顺序为 。
(4)如图2,t1℃时,若向烧杯中加入足量的 (填字母序号)并使之充分溶解,在试管中可观察到有晶体析出。
A.氯化钠
B.氢氧化钠
C.硝酸铵
如图是甲、乙、丙三种物质的溶解度曲线。请根据图中信息回答下列问题:
(1)甲、乙两种物质在 ℃时溶解度相等;
(2)t3℃时,把30克甲充分溶解在50克水中,所得溶液质量是 g;
(3)t3℃时,甲、乙、丙三种物质的等质量饱和溶液中,所含溶剂质量最多的是 ;
(4)若甲中混有少量乙,要得到纯净的甲,常用的提纯方法是 。

如图是甲、乙两种固体物质的溶液度曲线。请回答下列问题:
(1)a1℃时甲和乙的饱和溶液,升温到a2℃时 (填“仍是”或“不是”)饱和溶液。
(2)甲和乙的溶解度在 ℃时相等。
(3)a1℃时,将20g乙加入50g水中,所得溶液质量为 g。
(4)a2℃时,在100g水中加入25g甲,所得溶液溶质的质量分数为 。

作图法是常用的数据处理方法。如图是A、B、C三种物质的溶解度曲线图,请回答下列问题:
(1)P点的意义是 。
(2)t3℃时,A、B、C三种物质溶解度最大的是 。
(3)将某温度下C的不饱和溶液变成饱和溶液的方法是 (写一种)。
(4)在t3℃时,将A、B、C的饱和溶液分别降温到t1℃时,所得溶液溶质的质量分数由大到小的顺序是 。

试题篮
()