甲、乙、丙三种固体物质的溶解度曲线如图所示。请回答下列问题:
(1)P点表示的含义是 。
(2)t1℃时,将甲的不饱和溶液转化为该温度下饱和溶液的一种方法是 。
(3)t3℃时将90g甲的饱和溶液降温至t1℃,析出晶体的质量是 g。
(4)t3℃时,将等质量的三种物质的饱和溶液降温到t2℃,对所得溶液的叙述正确的是 (填字母序号)。
A.丙溶液的溶质质量分数不变 B.溶剂的质量关系是甲=乙>丙 C.溶液的质量关系是丙>乙>甲

如图为KNO3、NaCl两种固体物质的溶解度曲线,请回答下列问题:

(1)10℃时KNO3的溶解度 (填“<“、“=“或“>”)NaCl的溶解度。
(2)80℃时140g KNO3溶于100g水中形成的溶液是 (填“饱和”或“不饱和”)溶液。
(3)如图所示进行实验,再现结晶过程:

本实验条件下,影响析出晶体质量多少的主要因素是 、 。
如图是A、B、C三种固体物质的溶解度曲线。
(1)P点表示的含义是 。
(2)t1℃时,将35gA物质加入到50g水中,形成 (填“饱和”或“不饱和”)溶液。
(3)B中混有少量的A,提纯B的方法是 。
(4)将等质量的A、B、C三种固体物质分别配成t3℃时的饱和溶液,所得溶液的质量最多的是 。
(5)将t1℃时A、B、C三种物质的饱和溶液升温到t3℃时,所得溶液的溶质质量分数由大到小的关系是 。

利用溶解度曲线,可以获得许多有关物质溶解度的信息。如图是a、b、c三种物质的溶解度曲线。请回答下列问题:
(1)t3℃时,a、b、c三种物质溶解度由大到小的顺序是 。
(2)P点的含义 。
(3)将t1℃时a、b、c三种物质的饱和溶液升温到t2℃(不考虑水蒸发),所得溶液溶质质量分数由大到小的顺序是 。
(4)下列说法不正确的是 (填字母序号)。
A.将t3℃时等质量的a、b两种物质的饱和溶液降温到t2℃,析出晶体的质量a>b
B.t3℃时,配制溶质质量分数为50%的a溶液
C.将t3℃时a、b、c三种物质的饱和溶液各100g降温到t1℃,溶液中溶剂的质量为b<a=c

A、B、C三种物质的溶解度曲线如图。请回答下列问题。
(1)t1℃时,A物质的溶解度是 g。
(2)保持温度不变将B的不饱和溶液转化为饱和溶液,可采用的一种方法是 。
(3)将t2℃时等质量A、B、C三种物质的饱和溶液降温至t1℃,所得溶液中溶剂质量最少的是 。
(4)t1℃时将A、B、C三种物质各5g分别加入20g水中充分溶解,所得溶液质量的大小关系为 。

如图是硝酸钾的溶解度曲线,回答下列问题。
1)硝酸钾的溶解度随温度的升高而 。
(2)20℃时,100g硝酸钾饱和溶液中含硝酸钾的质量 (填“大于”、“等于”或“小于”)31.6g。
(3)图中点A所对应的是该温度下硝酸钾的 (填“饱和”或“不饱和”)溶液。

A、B、C三种固体物质的溶解度曲线如图所示。请回答
(1)P点的含义是 。
(2)t1℃时,将10gA物质投入到50g水中充分溶解后,所得溶液的质量为 g
(3)t2℃时,取等质量的A、B、C三种物质分别配制成饱和溶液,需要水的质量最小的是 。
(4)t3℃时,将接近饱和的C溶液变为该温度下的饱和溶液,下列分析正确的是 (填字母序号)。
A.溶质的质量一定变大
B.溶剂的质量一定变小
C.溶质的质量分数一定变大

如图为a、b、c三种不含结晶水的固体物质在水中的溶解度曲请回答下列问题:
(1)t1℃时,a、b、c三种物质溶解度由大到小的顺序为 。
(2)当b中混有少量a时,提纯b的方法是 。
(3)t4℃时,将等质量的a、b、c三种饱和溶液降温到t3℃时,所得溶液中,溶剂质量由大到小的顺序为 。
(4)t4℃时,在三个装有50g水的烧杯中分别加入a、b、c三种物质各20g,能形成不饱和溶液的是 ,再降温到t2℃时,所得三种溶液的溶质质量分数大小关系为 。

如图是甲、乙两种固体物质的溶解度曲线。
(1)甲的溶解度随着温度的升高而 。
(2)使接近饱和的甲溶液变为饱和溶液的一种方法是 。
(3)t℃时,甲的饱和溶液中溶质与溶液的质量比为 。
(4)乙中含有少量甲,提纯乙可采用的方法是 。

a、b、c三种固体物质的溶解度曲线如图所示,回答下列问题:
(1)M点的含义是 。
(2)在t2℃时,向盛有50ga物质的烧杯中加入80g水,充分溶解后,所得溶液的质量为 g。
(3)在t1℃时,将a、b、c三种物质的饱和溶液分别升温至t2℃,所得三种溶液溶质的质量分数由大到小的顺序是 。
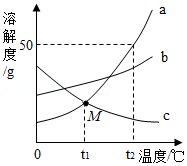
A、B、C三种物质的溶解度曲线如图所示,请回答下列问题:
(1)t2℃时,A、B、C三种物质溶解度的大小关系是 (用“A、B、C”和“>、<、=”表示)
(2)要使接近饱和的C溶液在保持溶质质量分数不变的情况下变成饱和溶液的方法是 。
(3)将100g质量分数为30%的A溶液由t3℃降温至t1℃,降温后所得溶液中溶质的质量分数是 。
(4)t3℃时,A、B、C三种物质的混合溶液中,A、B、C三种溶质的质量相等,将混合溶液在该温度下恒温蒸发溶剂,首先析出的物质是 。

硝酸钾的溶解度曲线如图所示。
(1)30℃时,硝酸钾的溶解度是 。
(2)60℃时,在200g水中加入120g硝酸钾固体,充分搅拌。
①所得溶液是 (填“饱和”或“不饱和”)溶液。
②将上述溶液降温至30℃,可析出硝酸钾晶体 g,此时溶液的溶质质量分数 (填“>”、“=”或“<”)45.8%。

溶液在生活、生产中具有广泛的用途。
(1)在20℃时,将20g氯化钾固体加入50g水中,充分搅拌后,仍有3g氯化钾固体未溶解。所得溶液中氯化钾的质量分数为 (计算结果保留一位小数);20℃时氯化钾的溶解度为 。
(2)甲、乙两种不含结晶水的固体物质的溶解度曲线如图。t1℃时,甲溶液的溶质质量分数与乙溶液的溶质质量分数相比,前者与后者的关系是 (填字母)。
A.大于 B.小于 C.等于 D.无法确定
(3)如图是实验室稀释浓硫酸的正确和错误操作,请说明不能将水直接倒入浓硫酸中进行稀释的原因 。


如图是几种固体物质的溶解度曲线。
(1)80℃时,KCl、NH4Cl与NaNO3的溶解度由大到小依次为 。
(2)20℃时,50g水中加入20g NaCl,充分搅拌后,形成 溶液(填“饱和”或“不饱和”)。
(3)60℃时,分别将相同质量的NaCl、NH4Cl与KNO3饱和溶液降温至20℃,析出晶体质量最大的是 。
(4)60℃时,配制KNO3溶液,其溶质质量分数最高不会超过 (精确到0.1%)。
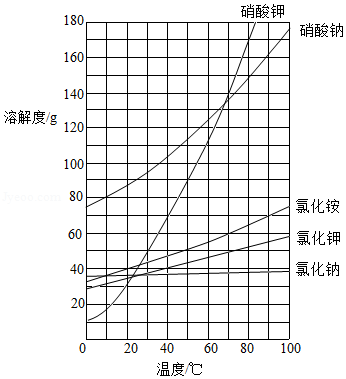
如图是A、B两种物质的溶解度曲线。
(1)0℃时,B的溶解度是 g;t1℃时,A、B的溶解度(S)的大小关系为:SA SB(填“>”、“=”或“<”)。
(2)现有t2℃的A、B的饱和溶液各100g,同时将两份溶液升温至t3℃(不考虑水的蒸发),则此时A、B两溶液的溶质质量分数(a)的大小关系为:ωA ωB(填“>”、“=”或“<”)
(3)现有t2℃的B的溶液100将其蒸发掉10g水,再将温度恢复到t2℃时,析出3gB.若继续蒸发掉10g水,仍将温度恢复到t2℃,此时析出B的质量 3g(填“>”、“=”或“≥”)。
(4)当A中混有少量的B时,提纯A采用的方法是 (填“蒸发结晶”或“降温结晶”)。
(5)现将经提纯的A用于配制一定溶质质量分数的溶液,实验中用到的仪器除了托盘天平(含砝码)、纸片、药匙、烧杯、玻璃棒、试剂瓶、标签外,还需用到的仪器有 。
试题篮
()