如图所示,室温下将120g NaOH固体加入100g水中。搅拌后固体全部溶解,放置一段时间恢复至室温后,析出11g固体。(忽略实验过程中水的损失)
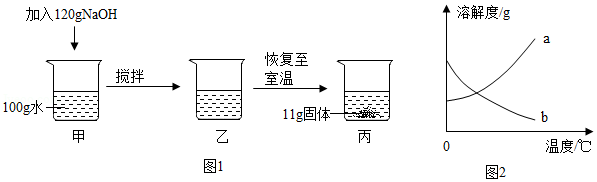
(1)丙中溶液为 (填“饱和”或“不饱和”)溶液。
(2)乙中溶液的质量为 g。
(3)室温时NaOH的溶解度是 g。
(4)上述实验说明NaOH的溶解度曲线与如图2中的 (填“a”或“b”)相似。
青海省柴达木盆地的察尔汗盐湖是我国最大的天然内陆咸水湖,当地农民通过“冬天捞碱,夏天晒盐”获得大量湖盐。
(1)“夏天晒盐”中的“盐”其溶解度可用图中 来表示(填“a”、或“b”、或“c”)。
(2)在t1℃时,三种物质的溶解度大小关系是 。
(3)在t2℃时,将40g的a放入50g水中充分搅拌,所得溶液质量为 g。
(4)将t2℃时a、b、c的饱和溶液降温至t1℃时,溶质的质量分数由大到小的顺序为 。

如图为硝酸钾、氯化钠两种物质的溶解度曲线,据图回答下列问题。
(1)在 ℃时,硝酸钾和氯化钠的溶解度相等。
(2)将40℃时接近饱和的硝酸钾溶液变为饱和溶液,可采用 (填“升高”或“降低”)温度的方法。
(3)比较在40℃时硝酸钾和氯化钠饱和溶液的溶质质量分数,硝酸钾 氯化钠(填“>”“=”“<”)。

从图表中获取信息是化学学习的基本能力。图1是氯化钠和硝酸钾在不同温度时的溶解度曲线。请回答下列问题:

(1)20℃时,氯化钠的溶解度是36g,其含义是 。
(2)60℃时,在50g水中加入70g硝酸钾固体,充分搅拌至固体不再溶解时,此时形成的溶液是 (填“饱和”或“不饱和”)溶液,溶液中溶质的质量分数为 (计算结果精确到0.1%)。
(3)图2中,当向盛有水的烧杯中缓慢倒入浓硫酸时,试管中观察到的现象是 。
甲、乙两种固体物质在水中的溶解度曲线如图所示。据图作答:
(1)甲、乙两物质的溶解度受温度影响较大的是 ;在0℃~t1℃之间时,相同温度下甲物质的溶解度 (填“>”“<”或“=”)乙物质的溶解度。
(2)t2℃时,把20g甲物质加入50g水中充分溶解,所得溶液为 (填“饱和”或“不饱和”)溶液,把该溶液降温到t1℃时,会析出甲物质 g。

如图为甲、乙、丙三种固体物质的溶解度曲线。
(1)由图可知, 的溶解度随温度的升高而减小。
(2)将t1℃时等质量的甲、乙、丙三种物质的饱和溶液都升温到t2℃(溶剂不蒸发),所得溶液中溶质的质量分数由大到小的顺序是 。

溶液及物质的溶解性对我们的生产生活有重要意义。如图是三种物质的溶解度曲线,请回答:
(1)三种物质中, 的溶解度受温度影响最大。
(2)80℃时硝酸钠的溶解度是 g。
(3)将70℃时三种物质的饱和溶液分别降温至30℃,所得溶液为不饱和溶液的是 溶液。
(4)硝酸钾属于复合肥料,所含营养元素有 ,溶质质量分数为3%的硝酸钾溶液常用作无土栽培的营养液,配制这种营养液150kg,需要硝酸钾固体的质量 kg。

请根据如图A、B、C三种固体物质的溶解度曲线,回答下列问题:
(1)t1℃时,将20g A物质加入到50g水中,充分溶解并恢复至原温度,所得溶液中溶质与溶剂的质量比为 。
(2)若A物质中混有少量B物质,最好采用 的方法提纯A物质(填“降温结晶”或“蒸发结晶”)。
(3)t1℃时,将A、B、C三种物质的饱和溶液升温至t2℃(不考虑水的蒸发),所得溶液的溶质质量分数由大到小的顺序是 。
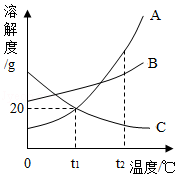
如图是a、b、c三种固体物质(均不含结晶水)的溶解度曲线图。请根据图示回答下列问题:
(1)20℃时,溶解度最大的是 。
(2)欲将c物质的饱和溶液变为不饱和溶液,可采用的方法是 (填“降低”或“升高”)温度。
(3)20℃时,向30g物质a中加入50g水,充分溶解并恢复到原温度,所得溶液中溶质的质量为 g。
(4)下列说法正确的是 。
A.当b中混有少量a时,可用蒸发结晶的方法提纯b
B.20℃时,用a、b、c三种固体配制等质量的饱和溶液,所需水的质量大小关系是b>a=c
C.将20℃的a、b、c三种物质的饱和溶液升温至t℃,所得溶液中溶质的质量分数大小关系为b>a>c
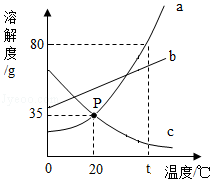
甲、乙、丙三种物质的溶解度曲线如图1所示。回答下列问题:

(1)当温度为 ℃时,甲、丙两种物质的溶解度相等。
(2)t3℃时,甲物质的饱和溶液中,溶质和溶液的质量比为 。
(3)若采用升温、恒温蒸发溶剂、增加溶质的方法都能使接近饱和的溶液变成饱和溶液,则该物质是 。
(4)R是甲,乙、丙三种物质中的一种,现用R作图2实验,①②中没有固体析出,③中有固体析出。根据图示信息,以下几种说法正确的是 (填标号)。

A.R是甲物质
B.①和②的溶液中,溶质质量相等
C.①②③中,只有③的上层清液是饱和溶液
D.①的溶液中溶质的质量分数比③的上层清液中溶质的质量分数小
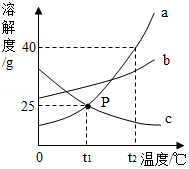
A、B、C三种固体物质的溶解度曲线如图所示,请完成下列问题:
(1)t3℃时,A、B、C三种物质的溶解度由大到小的顺序是 ;
(2)t2℃时,配制140g A物质的饱和溶液需要A物质的质量是 g;
(3)现有t1℃接近饱和的C溶液,在不改变溶液中溶质的质量分数的前提下,要使其变为饱和的溶液,可采取的一种措施是 ;
(4)若B中含有少量的A物质,可采用 方法提纯B。

如图是甲、乙、丙三种物质的溶解度曲线。

(1)t 1℃时,三种物质的溶解度由大到小的关系为 。
(2)t 2℃时,甲、乙、丙三种物质的饱和溶液降温至t 1℃时为不饱和溶液的是 。
(3)现有含少量甲的乙固体,若要通过结晶法进行提纯乙(甲与乙不发生反应),现有下列实验步骤可供选择:
①取一定量的水将固体溶解②充分冷却后过滤③趁热过滤④加热蒸发至大部分晶体析出⑤加热蒸发至溶液接近饱和⑥停止加热用余热将溶液蒸干⑦用少量水洗涤晶体并烘干。合理的操作顺序为 (按顺序填编号)。
(4)t 3℃时,取等质量甲、乙、丙三种物质的饱和溶液,恒温蒸发一定质量的水(析出的晶体均不含结晶水),析出晶体的质量关系为甲=乙<丙,则剩余溶液的质量由大到小的关系为 。
(5)t 2℃时,配制甲、乙、丙三种物质的饱和溶液,一定相等的是 (填字母)。
A.溶质质量
B.溶剂质量
C.溶质质量分数
D.溶解度
如图是a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点的含义是 ;
(2)t 2℃时,将50克a物质加入到100克水中,充分溶解后,所得溶液的质量是 克;
(3)若a中含有少量b,可用 的方法提纯a(选填"蒸发结晶"或"降温结晶");
(4)t 2℃时,等质量a、b、c三种物质的饱和溶液中溶剂质量由大到小的顺序为 。
根据KNO3和NaCl的溶解度曲线,回答下列问题。
(1)30℃时,KNO3和NaCl中溶解度较大的是 。
(2)20℃时,使接近饱和的KNO3溶液变为该温度下的饱和溶液的方法之一是 。
(3)为了使NaCl溶液中的溶质全部析出,应采用的方法是 结晶。

根据KNO3和NaCl的溶解度曲线,回答下列问题:
(1)10℃时,溶解度较小的是 (选填“KNO3”或“NaCl”);
(2)根据溶解度曲线分析,从海水中获得粗盐不采用降温结晶方法的原因是 ;
(3)下列说法正确的是 。
A.将不饱和的KNO3溶液变为饱和,可采用加KNO3的方法
B.20℃时,KNO3和NaCl两种饱和溶液中,所含溶质质量NaCl大于KNO3
C.30℃时,溶质质量分数为20%的KNO3溶液甲,降温至20℃得到溶液乙,再降温至10℃得到溶液丙,三种溶液中溶质的质量分数大小关系:甲=乙>丙

试题篮
()