如图是甲、乙两种固体物质的溶解度曲线。请回答:
(1)图中P点表示甲的溶液是 (填“饱和”或“不饱和”)的。
(2)要将t3℃时乙的饱和溶液变为不饱和溶液,可采用的方法是 (填一种即可)。
(3)将t2℃甲的饱和溶液降温至t1℃时,所得溶液的溶质质量分数 (填“变大”,“变小”或“不变”)。

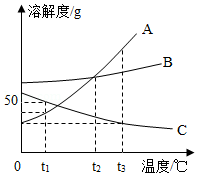
A、B、C三种固体物质的溶解度曲线如图所示,请完成下列问题:
(1)t3℃时,A、B、C三种物质的溶解度由大到小的顺序是 ;
(2)t2℃时,配制140g A物质的饱和溶液需要A物质的质量是 g;
(3)现有t1℃接近饱和的C溶液,在不改变溶液中溶质的质量分数的前提下,要使其变为饱和的溶液,可采取的一种措施是 ;
(4)若B中含有少量的A物质,可采用 方法提纯B。

如图1是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。回答下列问题:

(1)t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是 。
(2)P点表示,t2℃时,甲、丙两种物质的饱和溶液中,溶质与溶剂的质量比相等,均为 。
(3)t2℃时,取甲、乙两种固体各15g分别加入40g水中充分溶解,实验现象如图2所示,则烧杯a中溶解的物质是 (填“甲”或“乙”),所得溶液的质量为 g。
(4)当甲中含有少量的乙和丙(甲、乙、丙相互间均不发生化学反应)时,可采用 (填“降温”或“蒸发”)结晶的方法提纯甲物质。
(5)下列说法正确的是 (填字母序号)。
A.将甲物质的溶液由t3℃降温到t2℃,一定有晶体析出
B.将甲物质的饱和溶液由t2℃升温至t3℃时,其溶质质量分数增大
C.将t3℃时三种物质的饱和溶液恒温蒸发等质量的水,析出溶质的质量:甲>乙>丙
D.将t3℃三种物质的饱和溶液降温至t2℃,所得溶液的溶质质量分数:乙>甲=丙
水和溶液在生活、生产中起着重要作用。
(1)生活中常用 的方法降低水的硬度。
(2)净水器中用活性炭除去水中的异味,这是利用了活性炭的 性。
(3)如图是A、B、C三种固体物质的溶解度曲线。请回答下列问题:
①当温度为 ℃时,A、B两种物质的溶解度相等。
②A中混有少量的B时,提纯A的方法是 。
③t3℃时,将A、B、C三种物质的饱和溶液各300g,分别蒸发等量的水,所得溶液质量最大的是 。
④t3℃时,将A、B、C三种物质各25g分别加入到盛有50g水的烧杯中,充分溶解后,再降温到t1℃,所得溶液溶质质量分数大小关系为 (用“A、B、C”和“>、<、=”表示)。
根据所给氯化钠和碳酸钠的溶解度及溶解度曲线的信息,回答下列问题:
温度 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
氯化钠 溶解度/g |
35 |
35.5 |
36 |
36.5 |
37 |
碳酸钠溶解度/g |
6 |
10 |
18 |
36.5 |
50 |
(1)t1℃时,NaCl的溶解度是 g。
(2)t2℃时,将40g Na2CO3固体加入50g水中,充分溶解后所得Na2CO3溶液中溶质与溶剂的质量比为 。
(3)若Na2CO3中混有少量的NaCl,提纯Na2CO3应采取的方法是 (填“降温结晶”或“蒸发结晶”)

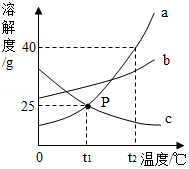
如图是a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点的含义是 ;
(2)t 2℃时,将50克a物质加入到100克水中,充分溶解后,所得溶液的质量是 克;
(3)若a中含有少量b,可用 的方法提纯a(选填"蒸发结晶"或"降温结晶");
(4)t 2℃时,等质量a、b、c三种物质的饱和溶液中溶剂质量由大到小的顺序为 。
硝酸钾、氯化钾的溶解度曲线如图1所示。
(1)P点的含义是 。
(2)当温度 时,氯化钾的溶解度大于硝酸钾的溶解度。
(3)t2℃时,分别将30g硝酸钾和氯化钾加入到50g水中,充分溶解后一定形成饱和溶液的是 ,其溶液的溶质质量分数为 (结果精确到0.1%)。
(4)图2是有关硝酸钾溶液的实验操作及变化情况。若保持溶液的质量不变,操作Ⅰ为 。
(5)下列有关说法不正确的是 。
A.①与②的溶质质量可能相等
B.②与③的溶质质量分数一定相等
C.等温度、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
D.等温度、等质量的硝酸钾和氯化钾饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
如图是NaCl和KNO3在不同温度下的溶解度曲线,根据曲线回答下列问题。
(1)t℃时,饱和NaCl溶液与饱和KNO3溶液的溶质质量分数 (填“相同”、“不同”或“无法确定”)。
(2)40℃时,相同质量的饱和NaCl溶液与饱和KNO3溶液均降温至20℃,析出晶体质量较多的是 。

根据KNO3和NaCl的溶解度曲线,回答下列问题:
(1)10℃时,溶解度较小的是 (选填“KNO3”或“NaCl”);
(2)根据溶解度曲线分析,从海水中获得粗盐不采用降温结晶方法的原因是 ;
(3)下列说法正确的是 。
A.将不饱和的KNO3溶液变为饱和,可采用加KNO3的方法
B.20℃时,KNO3和NaCl两种饱和溶液中,所含溶质质量NaCl大于KNO3
C.30℃时,溶质质量分数为20%的KNO3溶液甲,降温至20℃得到溶液乙,再降温至10℃得到溶液丙,三种溶液中溶质的质量分数大小关系:甲=乙>丙

甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题:
(1)t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是 。
(2)t3℃时,将20g物质丙加入50g水中充分溶解,并恢复到原温度,所得溶液的溶质质量分数为 。(结果保留到0.1%)
(3)在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是 。
(4)下列说法不正确的是 (填字母序号)。
A.t1℃时,用甲、乙、丙三种固体配制等质量的饱和溶液,所需水的质量大小关系是乙>甲>丙
B.t2℃时,甲、丙两物质饱和溶液中所含溶质质量相等
C.将t3℃时的甲、丙的饱和溶液降低温度至t2℃,所得溶液的溶质质量分数相等
D.乙中混有少量甲,可以采用蒸发结晶的方法提纯乙

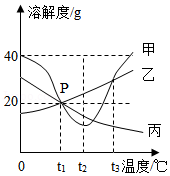
甲、乙、丙三种物质的溶解度曲线如图所示,请回答。
(1)P点的含义是 。
(2)气体的溶解度随温度变化的趋势与 (填“甲”、“乙”或“丙”)相似。
(3)t3℃时,将40g甲物质加到50g水中充分溶解后,所得溶液的质量为 g。
(4)若乙中含有少量甲,提纯乙的方法是 。
(5)将t3℃时等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,对所得溶液的分析正确的是 (填字母序号)。
A.溶解度:乙>甲>丙
B.溶剂质量:丙>乙>甲
C.溶液质量:乙>甲>丙
D.溶质质量分数:乙>甲>丙

(1)据报道,今年第一季度,南宁市成为全国省会城市的“水质冠军”。以下措施,你认为有利于爱护水资源的是 (填写字母编号)。
A.全民提高节约用水意识
B.应用新技术、新工艺减少污染物的产生
C.抑制水中所有动植物的生长
D.对污染的水体作处理使之符合排放标准
(2)生活中为了降低水的硬度并杀菌、消毒,常用的方法是 。
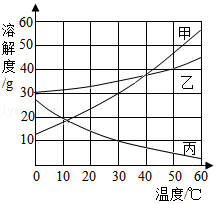
(3)A、B、C三种固体物质的溶解度曲线如图所示,请根据图中信息完成下列问题:
①溶解度随温度升高而降低的物质是 。
②t3℃时,A物质的溶解度是 。
③以下说法正确的是 。
A.将A的溶液由t2℃降温到t1℃,一定有晶体析出
B.在t3℃时,将等质量的A、B、C三种物质的饱和溶液降温到t1℃,所得溶液中溶剂质量最多的是A溶液
C.t1℃时将A、B、C三种物质各5g分别加入20g水中充分溶解,所得溶液质量的大小关系为C=B>A
D.将A、B、C三种物质的饱和溶液分别由t2℃升温到t3℃,所得溶液中溶质的质量分数最大的物质是B

甲、乙、丙三种物质(均不含结晶水)的溶解度曲线如图所示,回答下列问题:
(1)t1℃时P点的意义是 。
(2)t2℃时,比较甲、丙两物质的饱和溶液的溶质质量分数为:甲 丙(选填“>”、“=”或“<”)。
如图为甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。
①20℃时,甲、乙、丙的溶解度由大到小的顺序是 。
②30℃时,50g水中加入10g固体丙,充分溶解后,所得溶液的质量为 g;
③60℃时,将等质量的甲、乙、丙三种固体分别溶于水中,都恰好配制成饱和溶液,所得甲、乙、丙的三种饱和溶液的质量由大到小的顺序为 。
如图是三种常见固体物质的溶解度曲线。回答下列问题:

(1)KNO3的溶解度随温度升高的变化趋势是 (填“逐渐增大”或“逐渐减小”)。
(2)实验室配制溶液有如下步骤:(已知20℃时KCl的溶解度是34g)
①计算:20℃时,将67g的KCl饱和溶液稀释为20%,需加水18g。
②量取: 用量简量取水倒入烧杯中,提供的量筒规格有10mL、20mL、50mL,应该选择 mL的量筒。
③混匀:用 搅拌,使溶液混合均匀。
(3)根据以上溶解度曲线,判断下列说法正确的是 (多选)。
A.40℃时,KNO3的溶解度是64g,表示100g KNO3饱和溶液中含64g KNO3
B.Ca(OH)2的溶解度受温度变化的影响小于KCl的溶解度受温度变化的影响
C.KNO3混有少量KCl时,可用降温结晶法提纯
D.60℃时,将等质量的KNO3、KCl两种物质分别配制成饱和溶液,KNO3需要水的质量大于KCl
试题篮
()