硝酸钾、氯化钾的溶解度曲线如图1所示。
(1)P点的含义是 。
(2)当温度 时,氯化钾的溶解度大于硝酸钾的溶解度。
(3)t2℃时,分别将30g硝酸钾和氯化钾加入到50g水中,充分溶解后一定形成饱和溶液的是 ,其溶液的溶质质量分数为 (结果精确到0.1%)。
(4)图2是有关硝酸钾溶液的实验操作及变化情况。若保持溶液的质量不变,操作Ⅰ为 。
(5)下列有关说法不正确的是 。
A.①与②的溶质质量可能相等
B.②与③的溶质质量分数一定相等
C.等温度、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
D.等温度、等质量的硝酸钾和氯化钾饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
A、B、C三种固体物质的溶解度曲线如图所示。回答下列问题:
(1)t1℃时,A、B、C三种物质中溶解度最大的是 。
(2)t1℃时,在盛有100g水的烧杯中,加入50g B物质,充分溶解后,得到溶液的质量为 g。
(3)t1℃时,C的饱和溶液的溶质质量分数为 。
(4)将t1℃的A、B、C三种饱和溶液分别升温至t2℃,所得溶液中溶质质量分数由大到小的顺序是 。

甲、乙、丙三种物质的溶解度曲线如图所示。
(1)t1℃时,甲、乙、丙三种物质的溶解度由大到小顺序为 ;
(2)t2℃时,乙物质的溶解度为 g
(3)将t2℃时180g甲的饱和溶液降温到t1℃,析出晶体的质量为 g,所得甲溶液溶质质量分数为 。
(4)取等质量的甲、乙、丙三种物质,分别配制成t2℃时的恰好饱和溶液,所得三种溶液的质量由大到小顺序为 。

早在二十世纪初,我国化学家侯德榜在氨碱法制纯碱的基础上,创立了更为先进的侯氏制碱法,生产出Na2CO3的同时得到副产品NH4Cl,促进了世界制碱技术的发展。实验测得Na2CO3和NH4Cl的溶解度曲线如图所示,下列有关说法错误的是( )

A.t1℃时,100g的Na2CO3饱和溶液中含溶质20g
B.t1℃时,NH4Cl的溶解度大于Na2CO3的溶解度
C.t2℃时,Na2CO3和NH4Cl的饱和溶液中溶质质量分数相同
D.将t2℃的NH4Cl的饱和溶液降温至.t1℃,有NH4Cl晶体析出
如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )

A.a属于易溶性物质
B.t℃时c物质的饱和溶液,可采用升高温度方法使其变为不饱和溶液
C.90℃时,将50ga物质加入到50g水中充分搅拌,可得到100ga的饱和溶液
D.将20℃时三种物质的饱和溶液升温到90℃,所得溶液中溶质的质量分数的大小关系是:a>c>b
如图是甲、乙两种固体的溶解度曲线,回答下列问题:
(1)甲、乙溶解度相等时的温度为 ℃。
(2)t2℃时,将70g乙的饱和溶液与30g水混合,所得溶液中溶质的质量分数为 。
(3)将t2℃时的甲、乙饱和溶液各100g,分别降温至t1℃,所得溶液中溶质的质量的关系为:甲 乙(填“>”“<”或“=”)。
(4)甲中混有少量的乙,若提纯甲应采用的方法是 。

硫酸锂(Li2SO4)和硝酸钾在不同温度时的溶解度如表:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
|
溶解度/g |
Li2SO4 |
36.1 |
35.4 |
34.8 |
34.3 |
33.9 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
|
请回答下列问题
(1)依据溶解度表,绘制溶解度曲线如图1所示,其中能表示Li2SO4溶解度曲线的是 乙 。(填“甲”或“乙”)
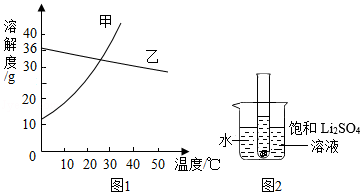
(2)Li2SO4和KNO3在某一温度时具有相同的溶解度x,则x的范围是 。
(3)40℃时,有含少量Li2SO4的KNO3饱和溶液,欲从中提纯KNO3晶体,方法是 。
(4)将10℃时两种物质的饱和溶液分别升温至30℃,所得Li2SO4溶液中溶质的质量分数 (填“>”、“<”或“=”)KNO3溶液中溶质的质量分数。
(5)如图2所示,20℃时,将盛有饱和Li2SO4溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出。则加入的物质可以是 (填字母序号)。
①浓硫酸②冰块③生石灰固体④硝酸铵固体⑤氢氧化钠固体
A.②④B.①③⑤C.③④D.①②⑤
(1)某地中考化学实验操作考试试题之一为测定肥皂水的pH,某考生用干燥的滴管吸取待测液 ,测得肥皂水的pH (填"<"、">"或"=")7。
(2)A、B、C三种固体物质(均不含结晶水)的溶解度曲线如图所示,请回答:
①t 1℃时,A、B、C三种物质的溶解度由大到小的顺序是 。
②当温度在t 1~t 3℃之间时,A物质与B物质 (填"能"或"不能")配制溶质质量分数相同的饱和溶液。
③将A、B、C三种物质的饱和溶液分别由t 2℃升温到t 3℃,所得溶液中溶质的质量分数最大的物质是 。
④t 3℃时,将75g A的饱和溶液稀释成20%的溶液需加 g水。

甲、乙、丙三种固体物质的溶解度曲线如图所示,下列相关说法正确的是( )

A.t2℃时甲和丙的溶解度都是60
B.t3℃时,甲、乙、丙三种物质的溶液中溶质质量分数一定是甲>乙>丙
C.将t3℃时甲和丙的饱和溶液降温到t2℃,两溶液的溶质质量分数相等
D.将t2℃时160g甲物质的饱和溶液降温到t1℃可析出20g固体(不含结晶水)
甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题:
(1)t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是 。
(2)t3℃时,将20g物质丙加入50g水中充分溶解,并恢复到原温度,所得溶液的溶质质量分数为 。(结果保留到0.1%)
(3)在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是 。
(4)下列说法不正确的是 (填字母序号)。
A.t1℃时,用甲、乙、丙三种固体配制等质量的饱和溶液,所需水的质量大小关系是乙>甲>丙
B.t2℃时,甲、丙两物质饱和溶液中所含溶质质量相等
C.将t3℃时的甲、丙的饱和溶液降低温度至t2℃,所得溶液的溶质质量分数相等
D.乙中混有少量甲,可以采用蒸发结晶的方法提纯乙

根据下面NaNO3在不同温度时的溶解度表回答问题。(忽略溶解时的热量变化)
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
溶解度/g |
80.8 |
87.6 |
94.9 |
103 |
113 |
124 |
136 |
149 |
(1)20℃时,将90g NaNO3固体加入盛有100g水的烧杯中,充分搅拌后,得到溶液的质量为 g。给烧杯加热,使溶液温度升至40℃时,溶液中溶质与溶剂的质量比为 。
(2)80℃时,将249g NaNO3饱和溶液降温至 时,溶液质量变为224g。
(3)50℃时,将200g溶质质量分数为50%的NaNO3溶液改为该温度下的饱和溶液,至少应向溶液中再加入 g NaNO3固体。
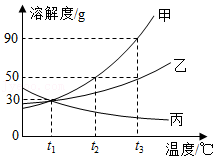
甲、乙、丙三种固体物质的溶解度曲线如图所示。据图回答下列问题:
(1)t2℃时,三种物质的溶解度由小到大的顺序是 。
(2)当温度为 ℃时,甲和丙两种物质的饱和溶液中溶质质量分数相等。
(3)若采用升温、恒温蒸发溶剂、增加溶质的方法都能使接近饱和的溶液变成饱和溶液,则该物质是 。
(4)将t3℃时甲和乙的饱和溶液分别降温至t2℃,析出晶体的质量关系为 。
A.甲>乙
B.甲=乙
C.甲<乙
D.无法确定
如图是甲、乙、丙三种固体物质的溶解度曲线。
(1)P点表示的含义为 。
(2)t1℃时,60g甲物质的饱和溶液升温到t2℃,再加 g甲物质,溶液仍然饱和。
(3)t2℃时,甲溶液中有少量丙,要提纯甲,用 结晶法。
(4)将t2℃时的甲、乙、丙的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序为 。

KNO3与NaCl的溶解度曲线如图所示。下列说法正确的是( )

A.NaCl的溶解度受温度影响的程度比KNO3的大
B.T1时,KNO3的溶解度比NaCl的大
C.T2时,KNO3与NaCl的饱和溶液质量分数相等
D.将T1时KNO3的不饱和溶液升温至T2,溶液变为饱和(不考虑溶剂蒸发)
试题篮
()