20 ℃时,向l00 g未知浓度的KCl溶液中加入6 g KCl 后,一定正确的是
A.溶液质量变为106 g B.溶质质量发生变化
C溶液浓度变大 D.溶剂质量不变
下列有关硝酸钾的溶解度说法正确的是
| A.将31.6克硝酸钾放入100克水中正好形成饱和溶液,其溶解度为31.6克 |
| B.20℃时硝酸钾的溶解度为31.6 |
| C.20℃时,100克硝酸钾饱和溶液中溶解了24克硝酸钾,其溶解度为24克 |
| D.20℃时50克水里溶解了15.8克硝酸钾正好达到饱和状态,那么20℃时硝酸钾的溶解度为31.6克 |
如图是a、b、c、三种不同物质(不含结晶水)的溶解度曲线图,下列有关叙述正确的是
| A.t1℃时,分别取出相同质量的a、c两种物质的饱和溶液升温到t2℃时,溶质的质量分数为a>c |
| B.t2℃,将a、b两种饱和溶液分别降温到t1℃时,析出的晶体的质量a>b |
| C.将a、b、c三种物质的饱和溶液分别从t1℃升温到t2℃,a和b溶液中溶质的质量分数增大,c溶液的溶质的质量分数减小 |
| D.从b物质的饱和溶液提取b晶体时最好采用冷却b物质的热饱和溶液的办法 |
t℃时,某物质的溶解度是10克,其饱和溶液中质量比关系正确的是
| A.溶液质量:溶剂质量=11:10 |
| B.溶液质量:溶质质量=10:1 |
| C.溶剂质量:溶质质量=1:1 |
| D.溶质质量:溶剂质量:溶液质量=1:9:10 |
甲、乙两种不含结晶水的固体物质的溶解度曲线如下图,下列说法中正确的是
| A.甲的溶解度比乙大 |
| B.t1℃时,甲的饱和溶液中溶质与溶液的质量比为1∶5 |
| C.t2℃时,甲、乙的两种饱和溶液中溶质的质量分数相等 |
| D.将等质量甲、乙的两种溶液分别由t3℃降温至t2℃,析出甲的质量一定比析出乙的质量大 |
如图所示的溶解度曲线图中,分别通过增加溶质、降低温度和温度不变的条件下蒸发溶剂这三种方法,均可使其不饱和溶液变为饱和溶液的是
| A.溶液甲 |
| B.溶液丙 |
| C.甲和丙的混合溶液 |
| D.丙和乙的混合溶液 |
如果将20℃时的氯化钠不饱和溶液转变为饱和溶液,可以采取的方法是
| A.升高温度 | B.加入水 |
| C.加入氯化钠固体 | D.倒掉一半溶液 |
如图所示的溶解度曲线图中,分别通过增加溶质、降低温度和温度不变的条件下蒸发溶剂这三种方法,均可使其不饱和溶液变为饱和溶液的是
| A.溶液甲 |
| B.溶液丙 |
| C.甲和丙的混合溶液 |
| D.丙和乙的混合溶液 |
下列实验现象的观察或记录中不正确的是
| A.向放有小粒碘的两个试管中分别加入水和汽油,碘几乎不溶于水,却可以溶解在汽油中 |
| B.向油和水的乳浊液中滴入4-5滴洗涤剂后振荡,静置后液体不再分为两层 |
| C.向一定量的水中加入少量硝酸铵,溶解后溶液的温度升高 |
| D.在滴加红墨水的水的试管中缓缓加入乙醇,然后振荡并静置几分钟,溶液不会分层 |
25℃时,向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中能正确表示此过程溶质质量变化规律的是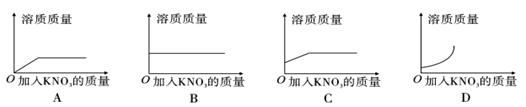
下图中能够正确反映其对应操作中各量的变化关系的是
| A.高温煅烧大理石 |
| B.氯酸钾与二氧化锰混合制取氧气 |
| C.向饱和澄清石灰水中加入固体CaO |
| D.20℃时向硝酸钾的不饱和溶液中不断加入固体硝酸钾 |
下图不能正确反映其对应操作中各量的变化关系的是
| A.加热氯酸钾和二氧化锰混合物制取氧气 |
| B.恒温时将NaCl不饱和溶液不断蒸发水 |
| C.向饱和Ca(OH)2溶液中不断加入CaO固体 |
| D.20℃时向蔗糖的不饱和溶液中不断加入蔗糖固体 |
将8克固体粉末投入10克水中,充分溶解后过滤,得到4克固体,再将这4克固体投入10克水中,充分溶解后过滤,得到2克固体。若上述过程保持温度不变,则原固体粉末属于
| A.纯净物 | B.混合物 | C.化合物 | D.无法判断 |
试题篮
()