(1)生铁和钢都是铁的合金,生铁的含碳量比钢 (填“高”或“低”);
(2)“八月桂花香”说明分子 ;
(3)我们穿的衣服通常由纤维织成。涤纶(的确良)、腈纶等属于合成纤维,而棉和羊毛属于 纤维。
分析与填空(先在A、B、C中选择一个正确选项填在相应的括号里,然后在D处再补充一个符合题意的答案。)
(1)混合物中含有多种物质。日常生活中的下列物质,属于混合物的是( )
A.氧气 B.蒸馏水 C.加碘食盐 D.
(2)合金是由一种金属和其他金属(或非金属)熔合形成的有金属特性的物质,它们比纯金属的应用更加广泛。下列物质属于合金的是( ) A.铜 B.黄铜 C.赤铁矿 D.
(3)固体物质的溶解度受很多因素的影响。下列因素中影响固体溶解度的是( )
A.溶解时搅拌 B.溶剂的性质 C.固体的颗粒大小 D.
铝是地壳中含量最高的金属元素,在生产生活中应用广泛。铝原子结构示
意图为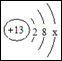 。请回答:
。请回答:
(1)图中x的数值为 ,铝原子的核内质子数为 。
(2)铝具有很好的抗腐蚀性能,原因是(用化学方程式表示) 。
20世纪90年代我国的硫酸产量已达到1600万吨,这标志着我国硫酸工业取得飞速发展。工业生产硫酸的主要流程为:
①煅烧黄铁矿4FeS2 + 11O2 点燃 2Fe2O3 + 8SO2; ②SO2转化为SO3;
③用浓H2SO4吸收SO3 ; 请回答相关问题:
(1)工业上如何利用流程①中形成的Fe2O3炼铁(用化学方程式表示): 。
(2)铁制品容易生锈是与空气中的 、 共同作用的结果,请你提出一条保护铁、防止铁生锈的方法 。
(3)SO2是一种酸性氧化物,具有与CO2相似的化学性质。生产中会有部分SO2随尾气排入大气,造成环境污染。有人设计用氢氧化钙吸收尾气中的SO2,反应生成Ca SO3和水;请写出此反应的化学方程式 ;
(10宁夏17).下表列出的是一种金属的部分性质:
| 硬度 |
密度 |
熔点 |
导电性 |
导热性 |
延展性 |
| 较软 |
2.70g/cm3 |
660℃ |
优良 |
优良 |
优良 |
(1)根据所列出的该金属的性质,该金属可用于制造 ,因为它既 又 。由于其密度仅约为铁的三分之一,所以它的合金是制造飞机机身的重要材料。要成为飞机机身材料,其合金的性质至少应在 方面与它的纯金属相比较要有明显提高。
(2)把这种金属放入稀盐酸中,可产生一种无色可燃性的气体。这说明该金属还可以与 溶液(写一种)反应,生成金属单质 。如果要证明其金属活动性比锌强,则它应可以与 溶液反应,生成单质 。
请完成下面填空:
(1)性质决定用途。以下连线正确的是_______(填字母):
(2)用Fe粉制成的食品保鲜剂使用一段时间后,会逐渐变为______ ______色的氧化铁。
(3)铁制品易发生锈蚀,请写出一种防止铁生锈的方法________ ___________。
(4)用氯化物_____ _____(填化学式)溶液可以一次性验证Fe、Cu、Ag三种金属的活动性顺序。
钢铁是使用最多的金属材料。
(1)生铁和钢都是铁合金,其中含碳量较高的是。
(2)人们常用"铜墙铁壁"来形容物体的坚固.但铁在一定条件下也能发生各种反应,如铁丝在氧气中燃烧,反应的化学方程式是。
(3)将mg氧化铜加入稀硫酸中完全溶解后,再加入铁粉充分反应,过滤,得到滤渣A和滤液B。再将滤渣A加入足量稀硫酸中,有气泡冒出,充分反应后,剩余固体物质的质量为12.8g
①滤渣的成分是,滤液B的成分是。
②原氧化铜的质量m=g。
铁、铝、铜是日常生活中使用最广泛的金属。
(1)上述三种金属中,人类最早大规模冶炼和使用的是铜,最晚的是铝,原因是________(填序号)。
A.三者在地壳中的含量,铜元素最高,铝元素最低
B.三者的金属活动性,铜元素最弱,铝元素最强
C.在自然界中,铜元素主要以单质形式存在,铝元素以化合物形式存在
(2)常温下一些金属的物理性质数据如下:
| 金属单质 |
铜 |
铝 |
锌 |
铁 |
铅 |
| 导电性(以银的导电性为100作标准) |
99 |
61 |
27 |
17 |
7.9 |
| 密度/(g·cm-3) |
8.92 |
2.70 |
7.14 |
7.86 |
11.3 |
| 熔点/℃ |
1083 |
660 |
419 |
1535 |
328 |
| 硬度(以金刚石的硬度为10作标准) |
2.5~3 |
2~2.9 |
2.5 |
4~5 |
1.5 |
分析上述数据,碎石用的大锤常用铁制而不用铝制,原因是
_________________________________________________________。
(3)铜器长期暴露在空气中,表面会生成铜绿[其成分可表示为Cu2(OH)2CO3],从其组成分析,预测铜绿能与___________(任举一例)反应。
(4)工业上火法炼铜的一个主要反应是Cu2S+O2 2Cu+SO2。Cu2S中铜元素的质量分数为_______________。用500吨含Cu2S 80%的铜矿石,理论上可以炼出___________吨铜。
2Cu+SO2。Cu2S中铜元素的质量分数为_______________。用500吨含Cu2S 80%的铜矿石,理论上可以炼出___________吨铜。
人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
(1)根据下图金属应用的实例推断,金属具有的物理性质有。

(2)铝的活动性比铁强,但铝在空气中却表现出良好的抗腐蚀性能,其原因是。
(3)据有关资料报导,现在世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20%~40%。请写出铁锈蚀的主要条件。
(4)合金在生产生活中得到广泛的应用,下列合金能用来制造人造骨的是(填序号)。
| A. | 不锈钢 | B. | 黄铜 | C. | 钛合金 | D. | 硬铝 |
归纳总结是学习化学的一种重要方法,下面是小亮同学总结出的结论,请你举出一个实例否定他的观点(要求用化学式或化学方程式表示)。

南宁至钦州段的高速铁路正在建设中。请回答下列问题:
(1)铁路建设中大量使用了以下材料:①石子;②钢筋水泥柱;③钢轨等,其中钢轨属于。
| A. | 金属材料 | B. | 合成材料 | C. | 有机天然材料 | D. | 无机非金属材料 |
(2)建设中,常用铝和氧化铁(
)在高温条件下,反应生成熔融状态下的铁单质对钢轨中的缝隙进行焊接。反应的化学方程式为:
,则
的化学式为,该反应的基本类型是。
(3)钢轨长时间使用后会生锈。铁锈的主要成分是
;除铁锈常用的一种试剂是。
(4)请写出防止铁制品锈蚀的两种常用方法:①;②。
汽车是现代生活中不可缺少的代步工具。请回答下列问题:
(1)汽车电路中的导线多数是用铜制做的,这是利用了金属铜的导电性和性。
(2)下列汽车配件及用品中,用合金制做的是(填字母)。
| A. |
钢铁外壳 |
B. |
玻璃车窗 |
C. |
橡胶轮胎 |
D. |
羊毛座垫 |
(3)铁在潮湿的空气中容易锈蚀。
①汽车表面喷漆,可以延缓汽车的锈蚀,其防锈原理是隔绝空气(氧气)和。
②喷漆前需将铁制品放人稀盐酸中除锈(铁锈主要成分是
),反应初期可观察到溶液由无色变为黄色,这是因为生成了(填化学式)的缘故;反应进行一会儿,又可以观察到有无色气泡产生,该反应的化学方程式是。
对比分析下列各物质,回答有关问题:
(1)生铁和钢都是铁合金,但硬度不同,愿意是;
(2)
和
都含有(填离子符号),都能与熟石灰反应产生氨气;
(3)稀硫酸和盐酸的化学性质相似,但除去
中的
只能用其中的。
在氦气、氧气、氢气、赤铁矿、磷矿粉5种物质中,选择符合要求的物质填写在横线上。
(1)工业炼铁的原料是。
(2)属于清洁能源的是。
(3)为延长灯泡使用寿命而充入的气体是。
试题篮
()