(1)1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖。将氢气和氮气在高温、高压和催化剂的条件下合成氨(NH3)。反应的化学方程式为_____________________________________________________。
(2)体育课上,剧烈运动后血液中产生了较多乳酸(C3H6O3),使人肌肉酸痛,经过一段时间放松,由于乳酸与吸入的氧气反应,生成二氧化碳和水,酸痛感消失。该反应的化学方程式为___________________________________。
新版《生活饮用水卫生标准》(简称新国标)中水质检测指标从原来的35项增加到106项.对供水各环节的水质提出了相应的要求.
(1)新国标在无机物指标中修订了镉、铅等的限量.这里的镉、铅指的是 (填序号).
| A.原子 | B.分子 |
| C.元素 | D.单质 |
(2)新国标中对水的pH的规定为6.5≤pH≤8.5.实验室用pH试纸测得自来水的pH=8,说明该自来水显 (填“酸”、“碱”或“中”)性.
(3)新国标中消毒剂由1项增至4项,加入了对用臭氧、二氧化氯和氯胺消毒的规定.①臭氧(O3)在消毒过程中转化为氧气.臭氧转化为氧气属于 (填“物理”或者“化学”)变化.②二氧化氯消毒过程中产生的次氯酸根离子(ClO﹣)也有消毒作用.ClO﹣中氯元素的化合价为 价③氯胺(NH2Cl)由 (填数字)种元素组成.用氯胺消毒时,反应的化学方程式是NH2Cl+X=NH3+HClO,其中X的化学式为 .
质量守恒定律的定量研究对化学科学发展具有重大作用。
(1)黑火药点燃时发生如下反应:2KNO3+S+3C K2S+3CO2↑+X↑,其中X的化学式为
K2S+3CO2↑+X↑,其中X的化学式为
(2)下图 A、 B、 C 三个实验用于验证质量守恒定律,其中不能达到目的的实验是___________
(选填序号),理由是___________。
甲、乙、丙、丁、戊是5种常见物质,由氢、氧、硫、钙4种元素中的1一3种组成。
(l)甲是无色有刺激性气味的气体,也是空气污染物之一,则甲的化学式是 。
(2)乙是一种无色液体,将人体呼出的气体吹人乙中出现浑浊现象,则液体乙是 。
(3)丙在一定条件下发生反应的微观示意图如下,在方框中补全相应微粒的图示。
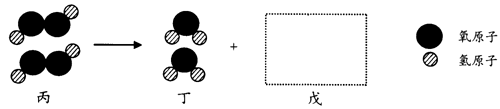
(4)丁在一定条件下反应生成戊,该反应的文字表达式为 。
(5)下列说法正确的是 (填字母序号)。
| A.甲、丁、戊都是氧化物 |
| B.甲、丙、戊中都含有氧分子 |
| C.丁和戊在一定条件下可以相互转化 |
| D.(3)和(4)中发生的反应都是分解反应 |
写出下列化学反应的符号表达式并在括号内注明反应基本类型(化合反应或分解反应)
(1)红磷在空气中燃烧 ( )反应
(2)实验室加热氯酸钾和二氧化锰的混合物 ( )反应
(3)乙烯(C2H4)燃烧生成水和二氧化碳
、
、
、
都是初中化学的常见物质,它们存在如下图所示的转化关系("-"表示两端的物质间能发生化学反应,"→"表示物质间存在转化关系。部分反应物、生成物及反应条件已略去)。
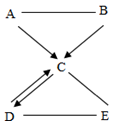
其中
、
为单质且
是可供动植物呼吸的气体;
是一种盐,
是常用于改良酸性土壤的碱。请回答下列问题:
(1)
的俗名是,
是。
(2)在一定条件下,
既可以转化成
,也可以与
发生化学反应。写出
和
反应的化学方程式。
(3)写出
与
反应的化学方程式。
烧杯中盛装一定质量的碳酸钠粉末,试管中是一定质量的稀盐酸,反应前称得总质量为M1。将稀盐酸倒入烧杯中,待反应完全后,称得总质量为M2。
(已知:Na2CO3+2HCl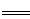 2NaCl+CO2↑+H2O)
2NaCl+CO2↑+H2O)
(1)实验现象除了产生大量气泡外,M1______M2。(填“>”,“<”或“=”)产生这种现象的原因____________________
(2)该反应__________(“遵守”或“不遵守”)质量守恒定律。
(3)若要用该实验来验证质量守恒定律,实验需在_______________容器中进行。
已知A、B、C是初中化学的常见物质,其相互关系如图所示.若A、B是组成元素相同且常温下都为液态的氧化物,C为供给呼吸,则A的化学式为 ,C为化学式为 ,反应①的化学方程式为 .
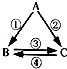
在用白磷探究质量守恒定律的实验中,同学将橡皮塞上的细玻璃管下端放到酒精灯火焰上灼烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并引燃白磷,实验过程如下图所示.请回答下列问题: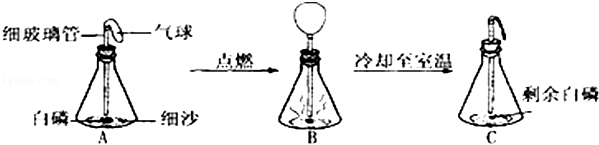
(1)图中瓶底铺细沙的作用是: .
(2)白磷刚引燃,立即将锥形瓶放到天平上称量,天平不平衡.结论是质量不守恒.待锥形瓶冷却后,重新放到托盘天平上称量,天平保持平衡.结论是:质量守恒.你认为结论正确的是 ( 填“前一种”或“后一种”).而导致另一种结论错误的原因是 ..
(3)实验观察到A、C中气球的大小不同,用理化知识解释产生此现象的原因是:
(4)由质量守恒定律可知,化学反应前后,一定不变的是 .(填序号)
①原子种类 ②原子数目 ③分子种类 ④分子数目 ⑤元素种类 ⑥物质种类.
将新鲜的鸡蛋浸泡在饱和石灰水中可使鸡蛋贮存6~7个月不变质.石灰水是用新烧制的生石灰配制成的,写出下列变化的化学方程式:
①烧制生石灰: ;
②配制石灰水 .
③石灰水可使鸡蛋不变质的原因是(用化学方程式表示) .
④浸泡一段时间后,鸡蛋的表面形成一层白色的覆盖物,白色覆盖物可以用稀盐酸除去,反应原理是 .
上面四个化学反应中,属于化合反应的是 ,属于分解反应的是 ,属于复分解反应的是 .(填番号)
下列基本技能都是你必须具备的,你能作出正确回答吗?
(1)用下列字母序号填空:
| A.石墨 | B.氮气 | C.二氧化硫 | D.氧气 |
①会形成酸雨的是 ;②充入食品包装袋以防腐的是 ;
③可用于铅笔芯的是 ;④医疗上用于抢救危重病人的是 。
(2)用相应的化学用语回答:
①两个氢原子 ;②三个水分子 ;
③两个硝酸根离子 ;④地壳中最多金属元素的氧化物 ;
(3)下面是四种粒子的结构示意图,用字母序号填空。

①属于同种元素的是 ;
②表示阴离子的是 ;
③AD表示的粒子形成的化合物为 ;(用化学式填空)。
已知A~F都是初中化学中的常见物质, A为黑色固体单质,C是无色无味气体,能是澄清石灰水变浑浊, D是红色固体,C→E是自然界中最常见的转化。物质间的转化关系如图所示:
(1)写出下列物质的化学式:B _________, E _________;
(2)写出A与B反应的化学方程式:_________________________
(1)天然水受到污染后,净化时需要运用科学的方法,同时要爱护水资源。
①自来水生产过程中先用 的方法除去水中不溶性杂质,再进行消毒。在操作中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是 。(填序号).

②若发现滤纸和漏斗间有气泡,可能的影响是__ ___,处理的方法是___ ___。
③地下水硬度过大会影响生产和生活,应软化后使用。检验硬水常用的物质是 。
④我市不少村镇小型河沟中藻类疯长,说明水体富营养化,你认为造成该现象的原因可能有_ 。
A.化学肥料流失到河中 B.排放的生活污水中有含磷洗涤剂
C.人畜的粪便流失到河中 D.工业废水的排放
⑤爱护水资源从我做起,下列做法可行的有 。
A.洗脸、刷牙时随时关闭水龙头 B.用洗菜、洗衣的水冲厕所、拖地
C.用洗衣机洗一两件衬衫 D.用残茶水浇灌某些花卉
(2)质量守恒定律的定量研究对化学科学发展具有重大意义。
已知m1g镁条放在空气中完全燃烧,生成m2g氧化镁(不考虑其它反应),则m1 m2,其化学反应方程式为 。
小西在做该实验时,用 夹持镁条,点燃,观察到耀眼的白光,冒出大量白烟,称量无误时,发现m1>m2,其原因是 。
钠是一种非常活泼的金属,它可以和冷水直接反应生成氢气和一种碱,但它不与煤油反应.把一小块银白色的金属钠投入盛有蒸馏水的烧杯中(如图a),可以看到钠浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和生成的氢气都发生燃烧.如果在上述盛蒸馏水的烧杯中先注入一些煤油,再投入金属钠,可以看到金属钠悬浮在煤油和水的界面上(如图b),同样与水发生剧烈的反应,但是不发生燃烧.则:

(1)写出钠和水反应的化学方程式 反应类型是
(2)在第二个实验中,钠也与水发生反应,但不发生燃烧,这是因为
(3)第一个实验中,钠浮在水面上;在第二个实验中,钠悬浮在煤油和水的界面上.这两个现象说明了金属钠具有的物理性质是
试题篮
()