现有一包粗盐,其中含有少量氯化镁、硫酸钠和不溶性的泥沙。为获取纯净氯化钠,设计如图实验方案:

阴离子 阳离子 |
OH﹣ |
Cl﹣ |
SO42﹣ |
CO32﹣ |
H+ |
溶、挥 |
溶 |
溶、挥 |
|
Na+ |
溶 |
溶 |
溶 |
溶 |
Ba2+ |
溶 |
溶 |
不 |
不 |
Mg2+ |
不 |
溶 |
溶 |
微 |
根据上述有关信息回答下列问题:
(1)滤渣1是 。
(2)向滤液1中加入过量NaOH溶液发生反应的化学方程式是 。
(3)滤液2中的溶质除NaCl外还有 (填化学式)。
(4)若④加入的盐酸不慎过量,对氯化钠的纯度 (填“有”或“无”)影响,理由是 。
请从A或B两题中任选一个作答,若两题均作答,按35﹣A计分.
| A用浓硫酸配制100g 9.8%的稀硫酸 |
B粗盐中难溶性杂质的去除 |
| (1)实验需要5.4mL浓硫酸和90mL水.量取两种液体用到的仪器有 (填序号). (2)稀释时,需将浓硫酸缓慢倒入水中,并不断进行搅拌,其原因是 . |
(1)过滤需要用到的仪器有 (填序号). (2)蒸发过程中,需不断进行搅拌,其原因是 . |
| 可供选择的主要仪器: ①试管 ②烧杯 ③蒸发皿 ④托盘天平 ⑤10mL量筒 ⑥100mL量筒 ⑦药匙 ⑧胶头滴管 ⑨漏斗 ⑩酒精灯⑪铁架台⑫玻璃棒 |
|
| |
|
(1)如图是利用海盐提取粗盐的过程:

如图中①是 池(填“蒸发”或“冷却”)。
(2)粗盐中含有少量CaCl2、MgCl2、Na2SO4和泥沙,某同学将该粗盐样品进行提纯。
①将样品加适量水溶解,然后进行 ,除去泥沙等难溶性杂质,得到澄清溶液;
②向所得的澄清溶液中依次加入稍过量的BaCl2溶液、NaOH溶液和 溶液,除去生成的沉淀后,再滴加稍过量的稀盐酸,得到较纯净的NaCl溶液;
③蒸发溶液,得到较多氯化钠固体时停止加热,他注意到不能立即把 直接放在实验台上,以免烫坏实验台。
(3)另一同学用所得的氯化钠和蒸馏水配制溶质质量分数为6%的氯化钠溶液。配制步骤: ①称量和量取 ②溶解 ③计算 ④装入试剂瓶贴好标签。配制上述溶液的正确顺序是 (填序号)。
下列实验方法错误的是( )
选项 |
实验目的 |
实验方法 |
A |
鉴别硬水和软水 |
加入肥皂水振荡,观察是否有大量泡沫 |
B |
鉴别蔗糖和NH4NO3固体 |
加入少量水溶解,测量溶液温度 |
C |
除去粗盐在难溶性杂质 |
加适量水溶解,过滤,蒸发 |
D |
除去KCl溶液中少量CuCl2 |
滴加NaOH溶液至不再生成沉淀,过滤 |
A.AB.BC.CD.D
去除难溶性杂质后的食盐样品中还含有可溶性杂质:CaCl2、MgCl2和Na2SO4.为除去可溶性杂质,将食盐样品溶于水,依次加入稍过量的三种溶液:BaCl2溶液、NaOH溶液、Na2CO3溶液。充分反应后过滤,得滤渣X,向滤液中加入过量的稀盐酸,搅拌、煮沸,得氯化钠溶液。下列说法正确的是( )

A.滤渣X中有三种成分
B.“向滤液中加入过量的稀盐酸”目的只是为了除去过量的NaOH
C.除杂过程中有Na2CO3参加的化学反应为复分解反应
D.将氯化钠溶液用题图装置加热蒸发,至水分完全蒸干时停止加热
海洋是巨大的资源宝库,从海洋中可以获得很多物质,连云港水资源丰富。
(1)通过晾晒海水得到的粗盐中含有多种可溶性杂质和不溶性杂质(泥沙等)。实验室中除去粗盐中不溶性杂质获得精盐的步骤是:溶解→过滤→蒸发→计算产率等。
①过滤操作中玻璃棒的末端要轻轻的斜靠在 一边。蒸发时为防止液滴飞溅,除用玻璃棒搅拌外,还可以采取的操作是 。
②下列操作可能导致精盐产率偏高的是 (填字母)
a.食盐没有完全溶解即过滤 b.过滤时液面高于滤纸边缘
c.器皿上粘有的精盐没有全部转移到称量纸上
(2)海水中含量最多的氯化物是氯化钠,其次是氯化镁。如图1是从海水中获得氯化镁溶液的流程。
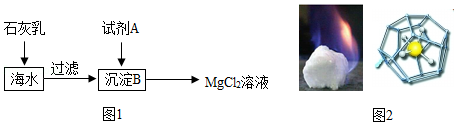
①在海水中加入石灰乳后,发生反应的化学方程式是 。
②上述过程中试剂A与沉淀B发生的是中和反应,则试剂A是(填名称) 。
(3)2017年5月18日,在中国南海海域实现可燃冰(CH 4•nH 2O)试采成功,这将使人类能源格局翻开新篇章。
①可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N 2、CO 2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于 (选填"纯净物"或"混合物")。
②若某种可燃冰中CH 4与H 2O的质量比是1:9,则该可燃冰中n= 。
③可燃冰中甲烷完全燃烧的化学方程式是 。
烟台有漫长的海岸线,蕴藏着丰富的海洋资源。
(1)海水淡化。可以采用如图1所示的膜分离法淡化海水,水分子可以通过淡化膜(海水中体积较大的盐的离子和其他分子不能通过)进入左侧的淡水池,从而得到淡水。下列说法中正确的是 (填字母序号)。
A.膜分离法的原理与滤纸过滤原理类似
B.膜分离法还可以浓缩海水中的盐类物质
C.膜分离法也是一种分离混合物的方法
D.该膜分离法的目的是除去海水中的不溶物
(2)粗盐提纯。除去难溶性杂质后的食盐水中还含有Ca2+、Mg2+、SO42﹣等杂质离子,为得到较纯的氯化钠,进行如下的实验操怍①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液③加入过量的NaOH溶液; ④加入适量的盐酸调节溶液的pH等于7;⑤过滤;⑥蒸发。下列操作顺序正确的是 (填字母序号),其中操作④加入适量的盐酸调节溶液的pH等于7的目的是 。
A.①③②④⑤⑥
B.③②①④⑤⑥
C.③①②⑤④⑥
D.②③①⑤④⑥
(3)海水资源综合利用的部分途径如图2。
①氨碱工业生产过程中,在加压并不断向饱和的氨盐水中通入二氧化碳的条件下,使碳酸氢钠结晶析出,该反应的化学方程式是 。
②写出步骤Ⅰ电解饱和NaCl溶液的化学方程式是 。
③海水制镁。实际生产中,步骤Ⅲ常选用 作为沉淀剂,从海水中提取MgCl2历经步骤Ⅱ、Ⅲ、Ⅳ三步转换的主要目的是 。
某校化学兴趣小组进行粗盐(含有泥沙)提纯实验,并利用所得精盐配制100g20%的氯化钠溶液。
实验一:如图1是甲同学进行粗盐提纯实验的操作示意图。
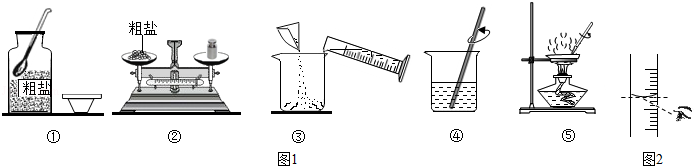
(1)操作①中的一处明显错误是 。
(2)操作⑤对应的实验中,停止加热的恰当时机是 。
(3)该同学实验中缺少过滤操作,在此操作中玻璃棒的作用是 。
实验二:乙同学用提纯得到的精盐配制100g20%的氯化钠溶液。
(4)配制时,除如图1提供的仪器外,还需要试剂瓶、镊子和 (填一种仪器名称)。
(5)若其他操作均正确,采用如图2所示观察方式量取水,则所配溶液的溶质质量分数 _ (填">"、"<"或"=")20%。
如图是利用海水提取氯化钠的过程:

(1)图中①是 (“结晶”或“吸附”)池。
(2)粗盐中含有不溶性的泥沙和少量可溶性的CaCl2、MgCl2、Na2SO4;将样品加适量水溶解,然后进行 ,除去泥沙等不溶性杂质。
(3)向所得溶液中依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液除去生成的沉淀后,再滴加稍过量的稀盐酸,得到较纯净的NaCl溶液。加入稍过量稀盐酸的目的是 。
(4)蒸发溶剂,得到纯净氯化钠固体。
通过海水晒盐可得到粗盐。化学兴趣小组为了除去粗盐中难溶性杂质,进行了如图操作:

(1)上述操作的正确顺序是 (填序号)。
(2)下列情况可能导致精盐产率偏低的是 (填字母代号)。
A.溶解时加入的水过少导致粗盐未溶完
B.过滤时漏斗内液面超过滤纸边缘
C.蒸发时有液体飞溅
D.所得精盐中含有少量水分
海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如图。
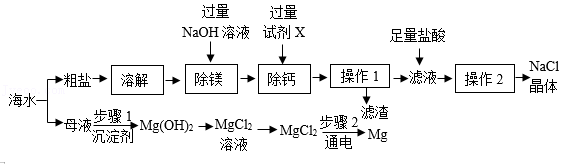
已知:粗盐中的杂质有泥沙、MgCl2、CaCl2,流程中部分操作及试剂已省略。
(1)试剂X的作用是除去粗盐中的Ca2+,则试剂X为 (填化学式)。
(2)“操作1”中玻璃棒的作用是 ,“操作2”的名称为 。
(3)滤渣中除泥沙外,还含有 。
(4)实际生产中,步骤1常选用 作为沉淀剂。
(5)步骤2需电解 状态的MgCl2以获得金属镁。
为除去粗盐中混有的泥沙,某学习小组按以下步骤进行实验:(实验环境温度为20℃)
Ⅰ.称量与溶解Ⅱ.过滤Ⅲ. 。
请回答下列问题:
(1)将步骤Ⅲ补充完整。
(2)如图中图1为氯化钠的溶解度曲线,图2为步骤Ⅰ中的部分操作:

①由图1给出的信息可知:20℃时,NaCl的溶解度是 g。
②从节约能源和提高产率的角度分析,图2中所需水的最佳体积是 mL.(提示:水的密度为1g•mL﹣1;产率 100%)
③用玻璃棒搅拌的目的是 。
(3)过滤时,若漏斗中的液面高于滤纸的边缘,造成的后果是 (填字母)。
a.过滤速度慢
b.滤纸破损
c.部分杂质未经过滤进入滤液
某同学为除去食盐水中的Na2SO4杂质,进行了以下实验:
下列有关说法错误的是( )
A.X为BaCl2溶液B.Y为Na2CO3
C.Z为稀盐酸D.步骤②与④可交换
为除去粗盐中含有的氯化镁、硫酸钠、氯化钙等杂质,应加入过量的氢氧化钠、氯化钡、碳酸钠等物质,将杂质转化为沉淀。过滤去除沉淀后,再向滤液中加入适量的盐酸得到精盐水。实验操作过程如图所示:

下列说法错误的是( )
A.实验操作步骤也可以是①③④②⑤⑥
B.操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7
C.在实验操作过程中,氯化钡和碳酸钠溶液的添加顺序可以颠倒
D.操作⑤得到的沉淀中共有四种物质
试题篮
()