MgSO4•7H2O是一种重要的化工原料,某工厂以一种镁矿石(主要成分为SiO2和MgCO3,还含有少量FeCO3)为原料制备MgSO4•7H2O的主要流程如图:

已知:SiO2既不溶于水也不溶于稀硫酸。请回答下列问题:
(1)“操作a”的名称是 。
(2)“废渣Y”中含有少量的 FeOOH,其中铁元素的化合价是 。
(3)MgCO3溶于稀硫酸的化学方程式为 。
(4)“溶液A”中加入H2O2溶液会生成Fe2(SO4)3,该反应的化学方程式为 。
(5)选用MgO调节pH使Fe3+转化为沉淀,而不选用NaOH的原因是 。
某兴趣小组利用废镍材料(含有金属Ni及少量Fe、Ag)探究相关物质的性质并回收镍,设计流程如图所示(部分产物略去)
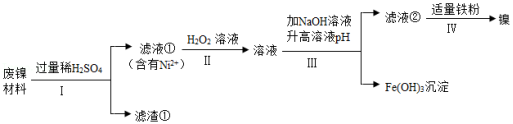
查阅资料:a.H 2O 2溶液可将Fe 2+转化为Fe 3+。
b.Fe 3+、Ni 2+转化为对应的氢氧化物沉淀时,溶液pH有如图关系:

(1)步骤Ⅰ的操作为 。
(2)滤渣①的成分为 。
(3)单质Fe参与反应的化学方程式为 (任写一个)。
(4)滤液②中有Ni 2+、无Fe 3+,则滤液②pH可能为 (填序号)。
A.pH=1
B.pH=2
C.pH=6
D.pH=10
(5)Ni、Fe、Ag三种金属的活动性由强到弱的顺序为 。
下列选项所示的物质间转化均能一步实现的是( )
A.Cu CuSO4
CuSO4 Cu(OH)2
Cu(OH)2
B.S SO2
SO2 H2SO4
H2SO4
C.Fe FeCl3
FeCl3 AgCl
AgCl
D.C CO2
CO2 CaCO3
CaCO3
新冠肺炎疫情防控期间,湘潭市各学校开展全域喷洒低浓度“84”消毒液进行消毒。“84”消毒液的有效成分是NaClO(次氯酸钠),模拟制备“84”消毒液的流程如图所示,其中A是密度最小的气体,B俗称烧碱,Cl2是一种黄绿色的有毒气体。请回答下列问题:
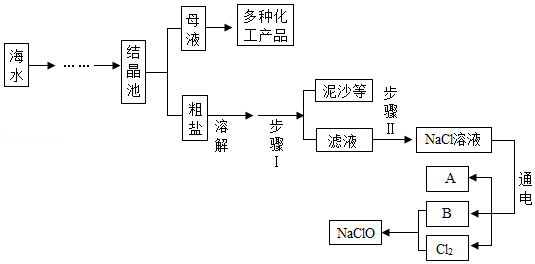
(1)A的化学式为 ,B的化学式为 。
(2)溶解过程中玻璃棒的作用是 ,步骤Ⅰ中主要的操作名称是 。
(3)步骤Ⅱ中,通常用碳酸钠来除去滤液中的氯化钙杂质,请写出有关反应的化学方程式 ,该反应属于 反应(填基本反应类型)。
(4)电解水时,一般在水中加入少量硫酸钠或氢氧化钠的目的是 ,不能加入NaCl的原因是 。
工业上,常采用“盐硝联产工艺”生产高纯度食盐,还可以制得硫酸钠。卤水中主要含有NaCl,还含有少量Na2SO4、CaSO4、MgSO4、CaCl2、MgCl2、FeCl3,用火碱和烟道气中的CO2为原料净化卤水,符合低碳经济发展要求。分析流程,回答问题:
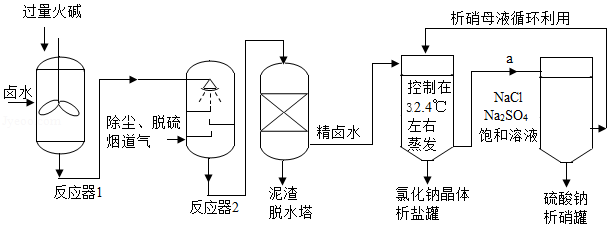
(1)反应器1中主要除去的离子是 (填符号)。
(2)烟道气通入反应器2前要脱硫,是为了除去有害气体 (填化学式)。反应器2中生成沉淀的化学方程式 (写一个)。
(3)下表为NaCl和Na2SO4在不同温度时的溶解度:
温度/℃ |
0 |
10 |
20 |
30 |
32.4 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
溶解度/g |
35.7 |
35.8 |
36.0 |
36.3 |
36.4 |
36.6 |
37.0 |
37.3 |
37.8 |
38.4 |
39.0 |
39.8 |
4.9 |
9.1 |
19.5 |
40.8 |
52.0 |
48.8 |
46.2 |
45.3 |
44.3 |
43.7 |
42.7 |
42.5 |
从析盐罐中排出的溶液a,在温度不变的条件下,每10g水中含有NaCl约 g.为提高Na2SO4纯度,析硝罐中析出Na2SO4,需采用 (填“升温”或“降温”)结晶方法。
CO、CO 2和CaCO 3的转化关系如图所示。下列说法错误的是( )

| A. |
①可通过物质的还原性实现 |
| B. |
②可通过物质的可燃性实现 |
| C. |
③可通过与澄清石灰水反应实现 |
| D. |
④可通过分解反应实现 |
甲、乙、丙三种物质的转化关系如图所示(“→”表示反应能一步实现,部分反应物、生成物和反应条件已略去)。回答下列问题:
(1)若甲是一种固态非金属单质,乙是一种可燃性气体,丙和乙的组成元素相同,写出乙→丙转化的化学方程式: 。
(2)若甲、乙的组成元素相同,乙是最常用的溶剂,丙是空气的主要成分之一,写出甲→丙转化的化学方程式: 。
(3)若甲、乙均为蓝色溶液,且乙可与AgNO3溶液反应生成不溶于稀硝酸的白色沉淀,丙为蓝色难溶于水的碱类物质,写出丙→乙转化的化学方程式: ,该反应的基本反应类型是 。

某种手机电路板主要含有Fe、Cu、Ag(银)、Ni(镍)等金属及非金属基材,如图是某工厂回收金属铜的工艺流程图。已知:2Cu+O2+2H2SO4 2CuSO4+2H2O。
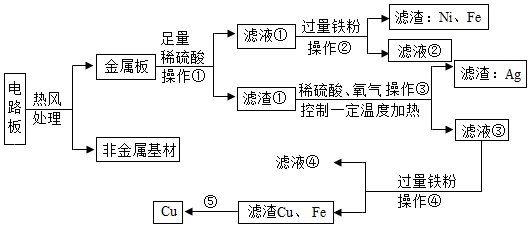
(1)电路板不直接焚烧而采取热风处理的主要目的是 。
(2)操作①的名称是 。
(3)写出滤液③与铁粉反应的化学方程式 。
(4)Fe、Cu、Ag、Ni在溶液中的金属活动性顺序由强到弱依次为 。
(5)写出⑤得到纯铜的一种方法 。
绘制知识网络是化学学习的一种有效方法,元素单质及其化合物的“价态—类别”二维图就是其中的网络图之一。如图是铁及其化合物的“价态—类别”二维图,下列有关说法或方程式正确的是( )
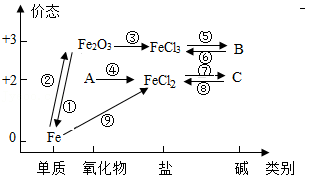
A.物质A的名称是氧化铁
B.①反应可能是Fe2O3+3Al 3AlO+2Fe
3AlO+2Fe
C.⑤反应可能是FeCl3+3NaOH═Fe(OH)3↓+3NaCl
D.⑤~⑨全部是复分解反应
古诗《石灰吟》:“千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间。”中蕴含了如图所示三种物质间的相互转化关系,下列说法不正确的是( )
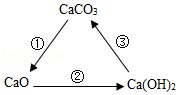
A.CaO俗名叫生石灰,是一种氧化物
B.“烈火焚烧若等闲”描述的是反应①的变化
C.反应②发生时,会放出热量
D.反应③是改良酸性土壤的原理
电子工业上制造铜电路板,常用30%的FeCl3溶液腐蚀镀铜电路板上的铜箔(Cu),如图是某兴趣小组设计的处理该生产过程中产生废液的流程图,据如图回答下列问题:
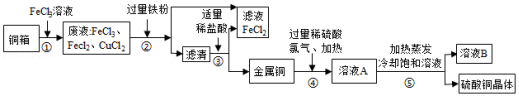
查阅资料:2Cu+2H2SO4+O2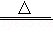 2CuSO4+2H2O;2FeCl3+Fe═3FeCl2
2CuSO4+2H2O;2FeCl3+Fe═3FeCl2
(1)步骤①所得的废液中只含有FeCl3、CuCl2、FeCl2三种溶质,据此可判断步骤①中铜与FeCl3反应生成的两种产物是 (写化学式)。
(2)步骤②中加入的铁粉与氯化铜发生反应的化学方程式是 ,步骤②还需要进行的实验操作是 。
(3)步骤③加入适量稀盐酸充分反应。当观察到 现象时,说明滤液中只剩下铜。
(4)步骤②③所得FeCl2可与一种气体单质发生化合反应生成FeCl3,实现循环使用,根据质量守恒定律可推测该单质是 。
(5)溶液B中含有的溶质是 。
人类常利用化学反应得到所需要的物质。如图是X、Y、Z、W四种物质的转化关系(都能通过一步反应实现),则X、Y、Z、W依次可能是( )

A.C、CO、CO2、H2CO3
B.H2O2、O2、H2O、H2
C.CaO、Ca(OH)2、CaCl2、CaCO3
D.Cu、CuO、Cu(OH)2、CuSO4
氯化亚铜CuCl是一种难溶于水和乙醇且在潮湿空气中易变质的物质,广泛应用于冶金、电镀、医药等行业、CuCl的制备流程如图:
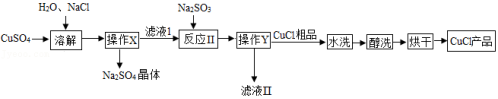
(1)"操作Y"名称是 。
(2)CuCl中铜元素的化合价为 。
(3)请配平"反应Ⅱ"的化学方程式: 。
(4)在"滤液Ⅱ"中可以循环利用的物质(水除外)是 。(填化学式)
(5)"醇洗"的目的是 ,防止后续过程中氯化亚铜变质。
2019年诺贝尔化学奖授予对锂离子电池研究作出贡献的三位科学家。如图是从钴酸锂废极片[主要成分为钴酸锂(LiCoO2)]中回收得到Co2O3和Li2CO3的一种工艺流程。
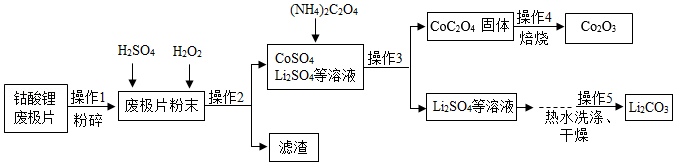
(1)操作1中,粉碎废极片的目的是 ;
(2)实验室中完成操作2时,需用到的玻璃仪器是 (填一种即可);
(3)操作4中,在高温条件下,CoC2O4在空气中反应生成Co2O3和二氧化碳,化学方程式为 ;
(4)操作5中,Li2CO3晶体用热水洗涤比用冷水洗涤损耗更少,说明Li2CO3的溶解度随温度升高而 。
试题篮
()