海洋是人类宝贵的自然资源,海水“晒盐”和海水“制碱”体现了人类利用和改造自然的智慧,请根据粗盐“制碱”的流程图(如图)回答问题:
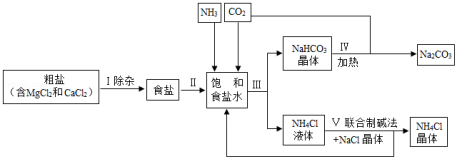
(1)步骤Ⅰ除杂中,常见的方法有两种:一是物理方法,即用NaCl溶液浸洗粗盐,溶解除去其中的可溶性杂质,则浸洗溶液应选用NaCl的 (填“饱和”或“不饱和”)溶液;二是化学方法,操作步骤依次为:加水溶解→加过量试剂①→加过量试剂②→过滤→加适量盐酸,以下试剂①②组合选用合理的是 。
A.①Ca(OH)2②Na2CO3
B.①Na2CO3②Ca(OH)2
C.①KOH②Na2CO3
D.①NaOH②Na2CO3
(2)步骤Ⅲ先向饱和食盐水中通入氨气,再通入二氧化碳,这样做的目的是 ,写出步骤Ⅲ反应的化学方程式 。
(3)步骤Ⅳ发生的反应属于 反应(填基本反应类型)。
(4)我国化学家侯德榜创立的联合制碱法的优点有 。
A.无“索尔维氨碱法”中的废弃物CaCl2生成,有利于保护环境
B.大大提高了食盐的利用率,节约了成本
C.将“制碱”与制氨生产联合起来,同时析出的NH4Cl晶体可用作复合肥
制造芯片的基材主要是高纯硅。如图是制备高纯硅的一种工艺流程:
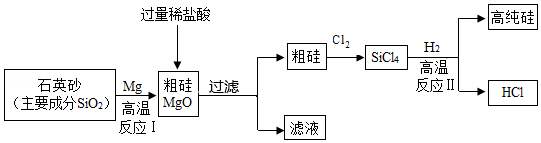
回答下列问题:
(1)反应Ⅰ的化学方程式是 。
(2)过滤所得粗硅应充分洗涤,以除去表面可能吸附的HCl和 (填化学式)。
(3)反应Ⅱ的基本类型属于 ;反应Ⅱ要在无氧气环境中进行,原因是 (答出一种即可)。
(4)上述生产流程中,可以循环利用的物质是 (填化学式)。
如图是某化工企业利用“侯氏制碱法”生产纯碱的部分工艺流程示意图:
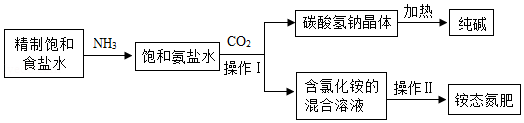
查阅资料知:①NH4Cl NH3↑+HCl↑;②氨气极易溶于水,氨水呈碱性。
(1)检验食盐水是否饱和的方法是 。
(2)操作Ⅰ的名称是 。实验室进行此操作时,玻璃棒的作用是 。
(3)“侯氏制碱法”中,向饱和氨盐水中通入足量的CO2,使氨气、水、NaCl和CO2反应生成NaHCO3等,该反应的化学方程式为 ;先通氨气形成饱和氨盐水,后加压通入二氧化碳,这样操作的目的是 。
(4)处理含氯化铵混合溶液时,不直接加热蒸干得到氯化铵固体的原因是 。
回答下列问题。
(1)从硝酸钾、少量氯化钠和不溶性杂质(泥沙)的混合物中得到硝酸钾的流程如图:
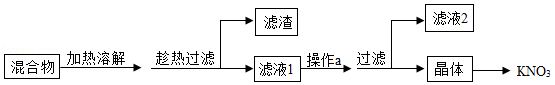
①结合如表分析,趁热过滤的原因是 。
温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
溶解度/g |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
|
②操作a的名称是 。
③滤液2的溶质是 。
(2)A~D为初中化学常见物质,A、D为金属,在常温下通过如图所示转化可获取硝酸钾。回答下列问题。
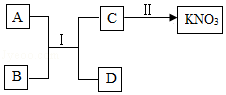
①反应Ⅰ能发生的原因是 。
②若D为银白色贵重金属,则反应i的化学方程式是 ,基本反应类型是 。
③一步实现反应Ⅱ,能否加入氯化钾?判断并说明理由 。
④硝酸钾可作化肥,能供给作物两种养分,属于 肥料。
一水硫酸四氨合铜的化学式为[Cu(NH3)4]SO4•H2O,是一种高效、安全的杀菌剂。它在乙醇﹣﹣水混合溶剂中的溶解度随乙醇体积分数的变化曲线如图甲所示。小明在实验室以氧化铜为主要原料合成该物质,他设计的合成路线如图乙所示:

(1)溶液A中一定存在的溶质为 。
(2)溶液B中含硫酸四氨合铜,“一系列操作”是指向溶液B中加入适量 、过滤、洗涤、干燥等。
2020年6月23日,我国长征五号B运载火箭搭载第55颗北斗导航卫星发射成功,北斗三号全球卫星导航系统星座部署全面完成。
Ⅰ.火箭中液氢燃料通过氢泵涡轮高速输送到发动机燃烧室,与液氧混合燃烧产生推动力。该反应的化学方程式为 。
Ⅱ.人造地球卫星的结构材料常用镁合金等,金属镁可从海水中提取,工艺流程如图:
(1)粗盐经过溶解、过滤、蒸发后得到的精盐是 (选填“纯净物”或“混合物”)。
(2)反应②的过程是 (选填“放热”或“吸热”)过程。
(3)“母液”中含MgCl2,以上①~④步化学反应中未涉及的反应类型是 。
a.化合反应
b.分解反应
c.复分解反应
d.置换反应
(4)已知某海域海水中总的含盐量约为3.5%,盐中镁元素的质量分数约为3.7%,则海水中镁元素的质量分数约为 (保留两位有效数字),由此可知,用海水晒盐后剩余的“母液”来提取镁,而不直接用海水的主要原因是 。
覆铜板是制作印刷线路板的基本材料。覆铜板中的金属Sn占2﹣10%,Cu占90﹣98%.简易工艺流程如图:
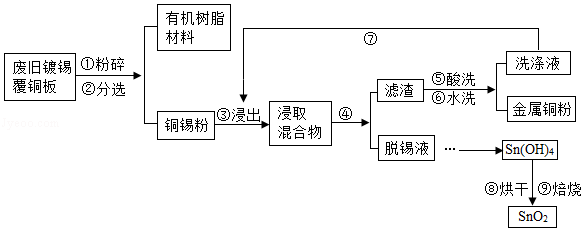
(1)将废旧镀锡覆铜板粉碎后,通过步骤②可将其分离为有机树脂材料(固体)和铜锡粉。根据化学常识回答,此工艺利用的是 的性质(填字母代号)。
a.溶解性不同
b.密度不同
c.沸点不同
(2)步骤④中涉及的分离操作是 (填操作名称)。
(3)通过步骤⑤和⑥所得洗涤液的pH 7(填“>”、“<”、“=”)。
(4)设计步骤⑦的主要目的是 。
(5)步骤⑨中涉及的主要化学方程式为 。
利用废弃的黄铜(含铜、锌)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图(反应条件已略去):
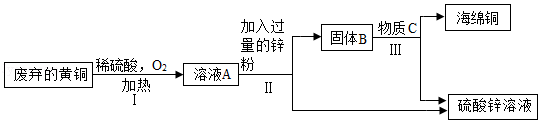
已知:2Cu+2H2SO4+O2 2CuSO4+2H2O
(1)过程Ⅱ中加入过量锌粉的目的是 。
(2)过程Ⅲ中有气体产生,所选用的物质C是 (填一种酸)。
海洋中蕴藏着丰富的化学资源,从海水中提取金属镁的主要步骤如图:
资料:海滩贝壳的主要成分是CaCO 3

(1)为节约资源,试剂X常用海滩贝壳为原料制得,则试剂X为 (填化学式);
(2)操作Y的名称为 ;
(3)在熔融状态下的MgCl 2,通电后会生成镁与一种气体单质,该反应的化学方程式为 。
(4)镁常用作合金,一般地合金相对于纯金属,具有的优良特性有 (填序号)。
A.硬度小
B.熔点高
C.抗腐蚀性强
新冠肺炎疫情防控期间,湘潭市各学校开展全域喷洒低浓度“84”消毒液进行消毒。“84”消毒液的有效成分是NaClO(次氯酸钠),模拟制备“84”消毒液的流程如图所示,其中A是密度最小的气体,B俗称烧碱,Cl2是一种黄绿色的有毒气体。请回答下列问题:
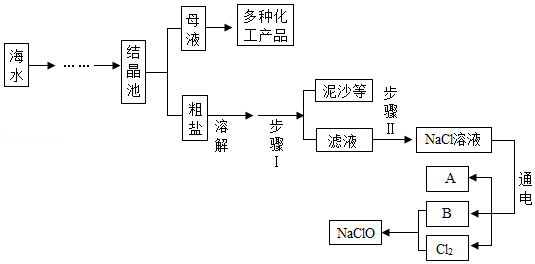
(1)A的化学式为 ,B的化学式为 。
(2)溶解过程中玻璃棒的作用是 ,步骤Ⅰ中主要的操作名称是 。
(3)步骤Ⅱ中,通常用碳酸钠来除去滤液中的氯化钙杂质,请写出有关反应的化学方程式 ,该反应属于 反应(填基本反应类型)。
(4)电解水时,一般在水中加入少量硫酸钠或氢氧化钠的目的是 ,不能加入NaCl的原因是 。
从盐湖中提取的某种矿物主要含有KCl,还有少量MgSO4、CaCl2及不溶性杂质SiO2.从该矿物中提取KCl的流程如图:
回答下列问题:
(1)滤渣I的主要成分是 。
(2)Y溶液中溶质的化学式为 。
(3)向滤液Ⅱ中加入过量盐酸的目的是 。
(4)蒸发溶液得到KCl固体的过程中,要用玻璃棒不断搅拌,目的是 。
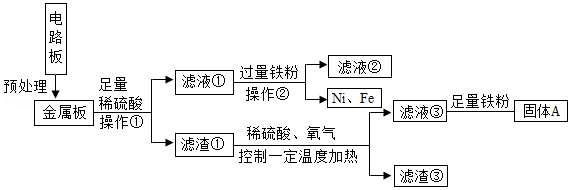
内江拥有中国西南地区最大的再生资源基地,可回收处理大量废旧塑料电器及玻璃等,某品牌电器的废旧电路板中含有Fe、Cu、Ag、Ni(镍,银白色金属) 等金属,如下图是某车间回收部分金属的工艺流程。已知,2Cu+O2+2H2SO4 2CuSO4+2H2O。
2CuSO4+2H2O。
回答下列问题。
(1)操作①中,使用的玻璃仪器除烧杯、玻璃棒外,还需 ;
(2)滤渣③中含有的金属是 ;
(3)根据以上工艺流程图,可以得出Ni、Fe的金属活动性强弱顺序是Ni Fe(填“>”或“<”)。
(4)滤液③中加入足量铁粉的主要目的是 ,固体A除主要含有铜外,还含有一定量的铁,为了进一步提纯铜,可以向固体A中加入适量的稀硫酸,发生反应的化学方程式为 ;
(5)相比于直接焚烧废旧电路板回收金属,该工艺流程的主要优点是 。
辉铜矿的主要成分为硫化亚铜(Cu2S),工业上用辉铜矿冶铜的一种工艺流程图如下:
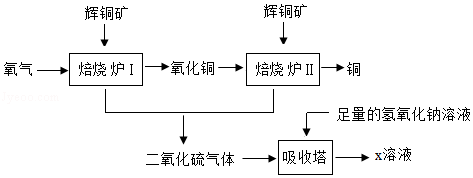
请你回答下列有关问题:
(1)硫化亚铜中铜元素的化合价为 。
(2)焙烧炉Ⅱ中发生反应的化学方程式为 。
(3)二氧化硫与二氧化碳具有相似的化学性质,则x溶液中盐的化学式是 。
某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示:

已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。
(1)烟泥最初处理需要除油污,用洗涤剂除油污的过程中发生了 现象。步骤①产生的废气B中,一定含有的有害气体是 (填化学式)。环保处理最好釆用的试剂是 (填字母序号)。
A、浓硫酸 B、食盐水 C、石灰乳
(2)写出步骤④中得到铜的化学方程式 ,它属于基本反应类型中的 反应。
(3)步骤③和④中主要操作的名称是 。
(4)我国古代就制得了一种外观似金子的锌和铜的合金,也就是黄铜,它的硬度比纯铜 (填“高”或者“低”)。
(5)取少量的溶液C,往其中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。往滤渣中加入稀盐酸有气泡产生,则滤液中一定没有 (填字母序号)。
A、硫酸镁 B、硫酸锌 C、硫酸铜 D、硫酸铜和硫酸锌
试题篮
()