硫酸亚铁是一种重要的补铁剂。实验室以废铁屑(含少量Fe2O3)为原料制备硫酸亚铁晶体的流程如图所示:
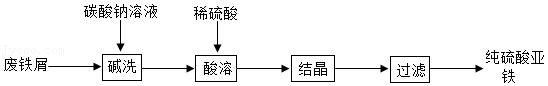
已知:铁与硫酸铁反应的化学方程式为Fe+Fe2(SO4)3═3FeSO4。
(1)“碱洗”是为了洗去铁屑表面的油污。用热的碳酸钠溶液浸泡,过滤,再用蒸馏水洗涤2~3次。取最后一次洗涤液,测其pH,若pH= ,说明洗涤液中无碳酸钠。
(2)“酸溶”是向“碱洗”过的铁屑中加入过量稀硫酸。
①写出铁与稀硫酸反应的化学方程式: 。
②所用硫酸溶液浓度不能太稀,原因是 。
③废铁屑中的少量Fe2O3不需要进行除杂处理,原因是 。
(3)“结晶”的相关操作依次为:蒸发浓缩、降温结晶。蒸发浓缩的目的是 ,便于结晶。
(4)含量测定:准确称取制得的硫酸亚铁样品2.82g于锥形瓶中,加蒸馏水完全溶解,加入稀硫酸,滴加溶质质量分数为1.58%的高锰酸钾溶液,当恰好完全反应时,消耗高锰酸钾溶液的体积为20.00mL(该高锰酸钾溶液密度近似为1g•mL﹣1)。列式计算该样品中硫酸亚铁的含量(结果用百分数表示,保留一位小数)。
已知:高锰酸钾与硫酸亚铁反应的化学方程式为10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H2O(相对分子质量:FeSO4=152,KMnO4=158)
如图所示,是小科建构的铜及其化合物之间相互转化的关系图。
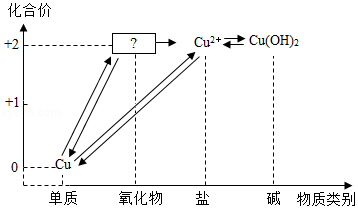
(1)写出图中“?”处物质的化学式 。
(2)要一步实现图中“Cu→Cu2+”的转化,可将铜加入适量的某种盐溶液中,则该溶液的溶质是 。
(3)根据图中的转化关系,利用硝酸铜溶液制备纯净的硫酸铜晶体。请设计一个实验方案,要求写出主要操
作步骤及所需要的试剂 。
以FeSO4•7H2O为原料制备铁红(Fe2O3)的一种方法如图:

已知“沉淀”时的主要反应为:2FeSO4+H2O2+2H2O═2FeO(OH)↓+2H2SO4
(1)FeO(OH)中铁元素的化合价为 。FeO(OH)可表示为mFe2O3•nFe(OH)3, 。
(2)“沉淀”时需控制溶液的pH与反应的温度。
①“沉淀”时调节溶液的初始pH约为4,过程中应始终保持溶液的pH为3.0~4.5,需不断加入物质Z调节溶液的pH,Z应具备的性质有 (填字母)。
A.能与酸反应
B.能与碱反应
C.不与FeO(OH)反应
②“沉淀”时反应温度不宜过高,其原因是 。
(3)“过滤”后需对固体进行洗涤与干燥。洗涤时被除去的沾于固体表面的阴离子为 (填离子符号)。
(4)“煅烧”时反应的化学方程式为 。
(5)如图为其他条件相同时不同煅烧温度对产品中Fe2O3质量分数的影响。煅烧温度较低时,产品中Fe2O3质量分数较低,其原因是 。当煅烧温度达800℃时,继续升高温度,产品中Fe2O3质量分数降低,且铁元素质量分数升高,所得产品发黑,其可能原因是 。

(6)用该方法制备Fe2O3,计算理论上13.9t FeSO4•7H2O(相对分子质量为278)可制得Fe2O3的质量(写出计算过程)。
硼及其化合物在现代工农业、医学、国防中有着重要的应用价值。利用硼镁矿可制备硼,工艺流程如图所示。请回答下列问题:

(1)B2O3中B元素的化合价为 。
(2)为加快硼镁矿石与浓NaOH溶液的反应速率,可采取的措施是 ;回收副产物Mg(OH)2可制得流程 的反应物。
(3)H3BO3加热分解只生成两种氧化物,流程②的化学反应方程式为 。
(4)根据流程③的化学反应方程式:B2O3+3Mg 2B+3MgO,理论上制备1.1吨的硼,需消耗镁多少吨写出计算过程)?
金属及其化合物在生产生活中有广泛的应用。

(一)金属的应用和防护
(1)用不锈钢、合成橡胶、氧化镁等材料制造的飞机轮胎属于 材料。
(2)航空煤油是飞机的燃料,它主要是由 炼制的。
(3)铁易生锈,提出防止铁生锈的一种方法 。
(4)特种钢中含有少量Mn、MnO2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为 。
(5)Mg(OH)2受热分解生成高熔点的MgO.Mg(OH)2可用作阻燃剂,其主要原理是 (选填序号)。
a.分解吸热,降低可燃物着火点 b.MgO覆盖燃烧物,隔绝氧气
(二)制备还原性铁粉
实验室利用废铁屑(含少量Fe2O3)为原料制备还原性铁粉的流程如下:
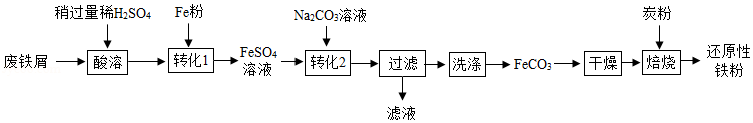
(1)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该反应的化学方程式为 。
(2)检验FeCO3已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加 溶液,无明显现象。
(3)“干燥”时有少量FeCO3发生下列转化:FeCO3 FeOOH+CO2,该转化的化学方程式为 。
(4)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是 。
(三)测定还原性铁粉的组成
还原性铁粉中含有少量FexCy,小组同学在老师的指导下进行以下实验。
资料:①Fe,FexCy在加热时与O2反应能生成相应氧化物。
②FexCy不与酸反应。
实验1:取29.52g样品,加入足量稀H2SO4,充分反应后生成1.00gH2。
实验2:另取29.52g样品,按如图进行实验。
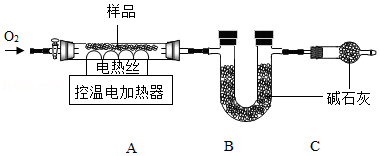
表:装置A和B的质量变化
装置 |
A |
B |
反应前 |
300.00 |
400.00 |
反应后 |
m |
400.44 |
实验后A中固体全部变为红棕色,装置A、B的质量变化如上表。
(1)装配好装置后,实验前先要 。
(2)装置C的作用是 。
(3)FexCy中,x:y= 。表中m的值是 。
反思:若用空气替代O2进行实验,测得x:y的值偏大,可能的原因是 。
水产养殖的速效增氧剂“鱼浮灵”的主要成分是过氧碳酸钠(aNa2CO3•bH2O2)。
某化学研究小组对“鱼浮灵”的制备、成分测定及增氧原理进行了如下探究。
【查阅资料】①过氧碳酸钠有Na2CO3和H2O2的双重性质;50℃开始分解。
②过氧碳酸钠在异丙醇(有机溶剂)中的溶解度较低。
Ⅰ.“鱼浮灵”的制备。
实验室用Na2CO3与稳定剂的混合溶液和30%的H2O2溶液反应制备过氧碳酸钠,实验装置如图所示。

(1)反应温度不能超过20℃的原因是 。
(2)反应结束后,停止搅拌,向反应液中加入异丙醇,静置过滤、洗涤、干燥,获得过氧碳酸钠固体。加入异丙醇的目的 。
Ⅱ.“鱼浮灵”的成分测定。
【定性检测】检测过氧碳酸钠溶液中的成分。
(3)请补充完成下列实验报告中的相关内容。
实验序号 |
实验步骤 |
实验现象 |
解释或结论 |
① |
取样,加入MnO2粉末,用带火星的木条伸入试管内 |
木条复燃 |
反应的化学方程式
|
② |
|
|
溶液中含有Na2CO3 |
【定量研究】测定“鱼浮灵”中过氧碳酸钠的组成。
实验③:称取一定质量的“鱼浮灵”样品于小烧杯中,加适量水溶解,向小烧杯中加入足量Ba(OH)2溶液,过滤、洗涤、干燥,得到碳酸钡(BaCO3)固体3.94g。
实验④:另称取相同质量的“鱼浮灵”样品于锥形瓶中,加入足量稀硫酸,再逐滴加入高锰酸钾溶液,充分反应,消耗KMnO4的质量为1.896g,该反应的原理是:2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O。
(4)计算确定过氧碳酸钠(aNa2CO3•bH2O2)的化学式(写出计算过程)。
Ⅲ.“鱼浮灵”的增氧原理。
研究小组通过测定常温下相同时间内水溶液中溶解氧的变化,探究CO32﹣、OH﹣对H2O2分解速率的影响,设计了对比实验,实验数据记录如下表。
编号 |
① |
② |
③ |
④ |
⑤ |
试剂 |
H2O |
4%H2O2溶液 |
Na2CO3固体 4%H2O2溶液 |
NaOH溶液 4%H2O2溶液 |
NaOH溶液 4%H2O2溶液 |
pH |
6.96 |
6.01 |
8.14 |
8.15 |
9.26 |
溶解氧 (mg•L﹣1) |
5.68 |
6.44 |
9.11 |
9.12 |
10.97 |
(5)由实验②可知,常温下,过氧化氢水溶液呈 (填“酸性”“中性”或“碱性”)。
(6)过氧碳酸钠可以速效增氧的原理是 。
钼是一种重要的金属,用它制成的合金有良好的机械性能,在工农业生产和国防上都有广泛的用途。如图是利用钼矿石(主要成分为MoS 2)制备金属钼的流程图:
信息:MoO 3+3H 2 Mo+3H 2O

请回答下列问题:
(1)反应①常将钼矿石粉碎,目的是 ;MoO 3中钼元素的化合价为 。
(2)操作Ⅰ的名称是 ;常用NaOH溶液吸收反应①的尾气,化学方程式为 。
(3)制得19.2吨金属钼,理论上至少需含MoO 380%的粗产品多少吨?请写出计算过程。
注:粗产品杂质中不含钼元素
碳酸钠广泛用于造纸、纺织、玻璃、洗涤剂、肥皂、制革等工业,是一种重要的化工原料。吕布兰、索尔维和侯德榜为碳酸钠的工业化生产作出了巨大贡献。
I、吕布兰法
1789年,法国医生吕布兰(N.Leblanc,1742﹣1806)以食盐、浓硫酸、木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如图:

(1)碳酸钠俗称 。
(2)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为
(3)③中“水浸”时通常需要搅拌,其目的是
(4)不断有科学家对吕布兰法进行改进,是因为此法有明显不足,请写出一条不足之处 。
Ⅱ、索尔维法
1892年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。原理如下:
NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。

实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min |
t0 |
t1 |
t2 |
t3 |
t4 |
t5 |
剩余固体质量/g |
未记录 |
15.3 |
13.7 |
11.9 |
10.6 |
10.6 |
请回答下列问题:
(5)饱和 NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为 ;
(6)三颈烧瓶上连接的长颈漏斗的主要作用是 ,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是 ;关闭K2停止通NH3后,还要继续通一段时间CO2,其目的是 ;
(7)根据实验记录,计算t2时 NaHCO3固体的分解率(已分解的 NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程。
若加热前 NaHCO3固体中还存在少量NaCl,上述计算结果将 (填“偏大”、“偏小或“无影响”)。
(8)制碱技术在很长一段时间内把持在英、法等西方国家手中,我国化学工程专家侯德榜先生独立摸索出索尔维法并公布与众,又于1943年创造性地将制碱与制氨两种工艺联合起来,基本消除废弃物的排放,同时生产出碳酸钠和氯化铵两种产品,这就是著名的侯氏制碱法。下列认识或理解正确的是
①科学认识是在曲折的、艰辛的积累过程中不断进步的;
②“科技兴邦、实业救国”是侯德榜先生回国研究的巨大动力;
③侯氏制碱法大大提高了原料的利用率,它符合当今“绿色化学”的理念。
镁元素广泛应用于火箭、导弹和飞机制造业,被称为“国防元素”。如图1所示为制取单质镁的转化过程,试回答下列问题:
如图转化过程中发生的化学反应主要有:

MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl═MgCl2+2H2O,MgCl2 Mg+Cl2↑
(1)在过程①中,所加石灰乳的主要成分是 (填写化学式)。
(2)过程②所发生的反应属于 (填“化合”“分解”“置换”或“复分解”)反应。
(3)下列有关过程③中能量转化的说法,正确的是 (填选项序号)。
A.电能转化为化学能 B.化学能转化为电能 C.潮汐能转化为化学能
(4)海水或卤水中本来就含有氯化镁,还需要过程①②的原因是 (选项序号)。
A.将氯化镁富集提纯 B.生成更多氯化镁 C.使石灰乳和稀盐酸反应
(5)某化学兴趣小组欲测定某氯化镁样品中MgCl2的含量(杂质为NaCl),称取10g该样品将其置于干净的烧杯中,加入适量水,使固体样品完全溶解。向所得溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与滴入NaOH溶液的质量关系如图所示。试回答下列问题:

①当滴入NaOH溶液120g时(即图中B点),烧杯中溶液里含有的溶质为 (写化学式)。
②当滴入10%的NaOH溶液80g时(即图中A点),恰好完全反应,试通过计算,求10g此氯化镁样品中MgCl2的质量。(计算结果精确至0.1g)
实验室有氧化铜和铁的混合粉末,为提炼其中的铜,取等质量样品,分别进行了两个实验。
实验一

①分离得到溶液C的操作名称是 。
②写出步骤II中反应的化学方程式 。
③上述步骤 (选填步骤编号)所包含的反应体现了铁的活动性比铜强。
实验二

④写出步骤Ⅳ中反应的化学方程式 。
⑤D、E是同一种溶质形成的溶液,请写出该溶质的名称,判断能否得出D、E溶液中该溶质质量的大小关系并说明理由。
通过化学变化可以制备物质。
(1)某兴趣小组欲用200g 4%的氢氧化钠溶液吸收二氧化碳制备碳酸钠,反应的化学方程式是 ;若要将提供的氢氧化钠全部转化为碳酸钠,请列出计算需二氧化碳质量(x)的比例式 ;
(2)在实验中,该小组同学发现,要定量控制通入氢氧化钠溶液中二氧化碳气体的质量,难以操作。请分析若通入二氧化碳气体的量不足时会导致产物中混有的杂质是 ;
(3)查阅资料:
Na2CO3+CO2+H2O=2NaHCO3;
NaHCO3+NaOH=Na2CO3+H2O;
该小组同学将制备方案改进如下:
步骤 |
实验操作 |
实验目的 |
一 |
将200g 4%的NaOH溶液分为两等份 |
/ |
二 |
① |
将其中一份溶液中的NaOH全部转化为NaHCO3 |
三 |
将步骤二所得溶液小心煮沸1﹣2分钟 |
② |
四 |
③ |
将NaHCO3全部转化为Na2CO3 |
(4)假设每步转化都完全,该小组同学利用改进后的方案制取的碳酸钠质量m1= g;经老师指导,该小组同学将步骤四反应后的溶液蒸干并充分灼烧得到碳酸钠粉末的质量为m2g,发现m1=m2,由此证明他们的方案改进成功。
碱式碳酸镁[Mg2(OH)2CO3]和过氧化镁(MgO2)都是重要化工原料。
Ⅰ.以Mg2(OH)2CO3为原料,制备产品MgO2的步骤如下:
(1)煅烧:煅烧Mg2(OH)2CO3得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水变浑浊,煅烧时反应的化学方程式为 。
(2)转化:向所得固体中加双氧水充分搅拌,发生反应MgO+H2O2=MgO2+H2O,温度升高,说明该反应 热量(填“放出”或“吸收”)。其他条件相同,煅烧温度、煅烧时间不同,所得MgO对MgO2产率(产率= ×100%)的影响分别如图1所示,则最佳的煅烧温度为 ℃、煅烧时间为 小时。
×100%)的影响分别如图1所示,则最佳的煅烧温度为 ℃、煅烧时间为 小时。

(3)分离:得到产品。
(4)测定:假设产品中仅少量MgO,某小组设计图2装置,通过测定生成O2体积,计算MgO2的质量分数。
已知:a.MnO2与稀盐酸不反应 b.MgO2+2HCl=MgCl2+H2O2
c.2MgO2 2MgO+O2↑ d.MgO+C
2MgO+O2↑ d.MgO+C Mg+CO↑
Mg+CO↑
①仪器M的名称是 ,MnO2的作用是 。
②相同条件下, 能使测定结果更准确。(填图2中“装置A”或“装置B”)
③实验室用溶质质量分数为37%、密度是1.18g•mL-1的浓盐酸配制10%的稀盐酸110g,需要水 mL.(水的密度是1g•mL﹣1,计算结果保留一位小数)
④经讨论,该小组又设计了下列3种方案,分别取5.0g产品进行实验,能确定MgO2质量分数的是 。(填序号)
a.加热,使MgO2完全分解,测出剩余固体的质量
b.与足量炭粉在高温下充分反应,测出生成Mg的质量
c.先加足量稀盐酸,再加足量NaOH溶液,充分反应,测出Mg(OH)2质量
Ⅱ.MgCl2是制备Mg2(OH)2CO3的原料,现用含碳酸镁84%的菱镁矿制备MgCl2,反应如下:MgCO3+Cl2+CO MgCl2+2CO2(设杂质不参加反应)。生产19吨MgCl2需要这样的菱镁矿多少吨?(写出计算过程)
MgCl2+2CO2(设杂质不参加反应)。生产19吨MgCl2需要这样的菱镁矿多少吨?(写出计算过程)
二氧化锰因在工业生产中应用广泛而备受关注,制备二氧化锰是一项有意义的工作,某研究性小组对此展开了系列研究。
Ⅰ.用高锰酸钾制备
资料一:(1)3K2MnO4+2H2SO4═2KMnO4+MnO2↓+2K2SO4+H2O
(2)K2MnO4易溶于水
实验室加热高锰酸钾制氧气,反应的化学方程式为 。其反应类型是 。将反应后的固体剩余物用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2,用稀硫酸而不用水浸取的原因是 。
Ⅱ.用硫酸锰制备:电解MnSO4溶液可制得活性MnO2,同时生成氢气和硫酸,该反应的化学方程式为 ,一段时间后溶液的pH将 (填“变大”、“变小”或“不变”)
Ⅲ.用废锂电池制备
资料二:2Al+2NaOH+2H2O═2NaAlO2+3H2↑
用废锂电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)制备纳米MnO2,并进行锂资源回收,流程如下:

请回答下列问题:
(1)“滤液”中溶质的主要成分是 (填化学式)。
(2)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、漏斗和 。
(3)MnO2与碳粉经下列三步反应制得纳米MnO2:
①2MnO2+C  2MnO+CO2↑
2MnO+CO2↑
②MnO+H2SO4═MnSO4+H2O
③3MnSO4+2KMnO4+2H2O═5MnO2↓+K2SO4+2H2SO4
上述涉及元素化合价变化的反应有 (填序号)。
IV.用碳酸锰制备
控制一定的温度,焙烧MnCO3制取MnO2的装置如下:

(1)实验中观察到澄清石灰水变浑浊,写出石英管中发生反应的化学方程式 。
(2)MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如图所示。图中B点对应固体成分的化学式为 (请写出计算过程)
绿矾(FeSO4•7H2O)是硫酸法生产太白粉的主要副产物,可用于制备Fe2O3,复印用Fe3O4粉、还原铁粉等,开发利用绿矾工艺是一项十分有意义的工作。某研究性小组展开了系列研究。
Ⅰ制备Fe2O3
【资料一】
(1)无水硫酸铜遇水变成蓝色的硫酸铜晶体。
(2)绿矾(FeSO4•7H2O)高温分解产生一种金属氧化物和几种气态非金属氧化物。
(3)SO2是无色有窒息性臭味的有毒气体,能使品红溶液褪色。
甲同学用如下装置制备Fe2O3并验证绿矾受热分解的其他产物;

实验过程中发现:A中有 色固体生成,B中无水硫酸铜变蓝,C中U形管内有无色晶体(SO3)析出,D中品红溶液褪色,装置E的作用是 ,绿矾高温分解的化学方程式为 。
Ⅱ制备Fe3O4
乙同学模拟生产复印用Fe3O4粉的实验流程如下:

【资料二】Fe(OH)2是一种白色难溶于水的固体,在空气中易被氧化。
FeSO4溶液中加入NaOH溶液,反应的化学方程式依次为① ,②4Fe(OH)2+O2+2H2O═4Fe(OH)3.由沉淀a获得Fe3O4的化学方程式为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
若制取Fe(OH)2,采取的实验操作是:向盛有5mL新制FeSO4溶液的试管中加入10滴植物油,然后用胶头滴管加煮沸的NaOH溶液(驱赶O2),胶头滴管的正确使用方法是 (填字母)。

Ⅲ制备还原铁粉
制备还原铁粉的工业流程如下:

(1)操作1的名称是 ,NH4HCO3和FeSO4溶液反应的化学方程式为 。
(2)若将14.06g粗还原铁粉(假设粗还原铁粉中杂质仅含少量FexC)在氧气流中完全反应,得到0.22gCO2,将相同质量的粗还原铁粉与足量稀硫酸反应,得到0.48gH2(FexC与稀硫酸反应不产生H2)。试通过计算确定FexC的化学式(请写出计算过程) 。
(3)粗还原铁粉经加工处理后变成纯还原铁粉,纯还原铁粉和水蒸气在高温条件下也可制得四氧化三铁,同时生成一种气体。其装置如图所示:

SAP材料吸水性强,湿润的SAP材料能为该反应持续提供水蒸气。实验开始一段时间后,观察到在肥皂液中有大量的气泡产生,此气泡用火柴即能点燃,同时有肥皂泡飘到空中。生成的气体是 ,干燥的SAP材料作用是 。
试题篮
()