回收利用是保护金属资源的一条有效途径,某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液.主要流程如图:

已知:CuO+H 2SO 4═CuSO 4+H 2O Fe+Fe 2(SO 4) 3═3FeSO 4
(1)流程Ⅰ中氧化铁发生反应的化学方程式是 .
(2)流程Ⅲ充分反应后,还应有的实验操作是 .
(3)A﹣E中,含有铁、铜两种元素的是 (填字母).
硅酸钠(Na2SiO3)是我国优先发展的精细化学品,用某种石英砂矿石(主要成分是SiO2,还含有少量的CuO、Na2SO4、Na2CO3)制备硅酸钠(Na2SiO3)的流程如下:

资料:SiO2既不溶于水,也不与盐酸反应。
请回答下列问题:
(1)“研磨”的目的是 。
(2)检验“洗涤a”已洗净的方法是 。
(3)“酸浸”的化学方程式为 。
(4)“碱浸”的化学方程式为 。
(5)“操作a”包含蒸发浓缩、 、过滤、洗涤、干燥等一系列操作。
某工厂产生的烧渣(主要含FeO、Fe 2O 3,还有一定量的SiO 2)可用于制备七水合硫酸亚铁晶体(FeSO 4•7H 2O),其工艺流程如下:

查阅资料:SiO 2不溶于水,也不与稀硫酸反应。
(1)"浸取"步骤中,FeO、Fe 2O 3和稀硫酸发生反应的化学方程式分别为
FeO+H 2SO 4=FeSO 4+H 2O、 。
(2)为提高"浸取"步骤的反应速率,可采取的具体措施有 (写2条,不考虑"搅拌"和"使用催化剂")。
(3)"还原"步骤的目的是将Fe 3+转化为Fe 2+,试剂X可用SO 2或Fe。
①若试剂X是SO 2,转化原理为SO 2+Fe 2(SO 4) 3+2Y═2FeSO 4+2H 2SO 4,则Y的化学式是 。
②若试剂X是Fe,转化原理为Fe+Fe 2(SO 4) 3=3FeSO 4.测得"还原"后溶液的pH明显增大,其原因是 。
海洋是巨大的资源宝库,从海洋中可以获得很多物质,连云港水资源丰富。
(1)通过晾晒海水得到的粗盐中含有多种可溶性杂质和不溶性杂质(泥沙等)。实验室中除去粗盐中不溶性杂质获得精盐的步骤是:溶解→过滤→蒸发→计算产率等。
①过滤操作中玻璃棒的末端要轻轻的斜靠在 一边。蒸发时为防止液滴飞溅,除用玻璃棒搅拌外,还可以采取的操作是 。
②下列操作可能导致精盐产率偏高的是 (填字母)
a.食盐没有完全溶解即过滤 b.过滤时液面高于滤纸边缘
c.器皿上粘有的精盐没有全部转移到称量纸上
(2)海水中含量最多的氯化物是氯化钠,其次是氯化镁。如图1是从海水中获得氯化镁溶液的流程。
①在海水中加入石灰乳后,发生反应的化学方程式是 。
②上述过程中试剂A与沉淀B发生的是中和反应,则试剂A是(填名称) 。
(3)2017年5月18日,在中国南海海域实现可燃冰(CH 4•nH 2O)试采成功,这将使人类能源格局翻开新篇章。
①可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N 2、CO 2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于 (选填"纯净物"或"混合物")。
②若某种可燃冰中CH 4与H 2O的质量比是1:9,则该可燃冰中n= 。
③可燃冰中甲烷完全燃烧的化学方程式是 。
碳酸钙是一种重要的无机化工产品,工业上有重质碳酸钙、轻质碳酸钙、纳米碳酸钙等不同品种.以下是两种碳酸钙产品的主要生产过程.请回答下列问题:
| 原料 |
主要生产过程 |
产品 |
|
| 石灰石 |
1.高温煅烧,得到固体A与气体B 2.固体A与水反应,净化后得到石灰乳 |
石灰乳与B反应 |
轻质碳酸钙 |
| 石灰乳与适量盐酸反应得溶液C,C中加入氨水同时通入B |
纳米碳酸钙 |
||
(1)A的主要成分俗称 ,A与水的反应过程中 (填"吸收"或"放出")热量.石灰乳的主要成分是 .
(2)石灰乳中加入纯碱溶液,也可得到碳酸钙,请写出该反应的化学方程式 ,该反应属于 (填基本反应类型)反应.
(3)C溶液中的溶质是 ,C与氨水、气体B反应除得到纳米碳酸钙之外,另一种副产品是 .
氧化锌软膏可用于急性或亚急性皮炎、湿疹、痱子及轻度、小面积的皮肤溃疡。闪锌矿(主要成分为ZnS)是含锌的主要矿物质之一,高温煅烧闪锌矿生成氧化锌和SO2,以氧化锌产品为原料制备纯氧化锌的生产工艺流程如图:
(1)已知A为碳酸锌和硫酸钠的混合物,则滤渣2的化学式为 。
(2)上述步骤中,步骤⑥的操作是 (填操作名称)。
(3)在上述步骤中,步骤 发生的反应属于分解反应。
(4)步骤④中发生的反应化学方程式为 (提示:ZnO与酸反应和Fe2O3与酸反应类似)。
图1中铁钉A长期放置于空气中可能生锈变成B,图2是A和B可发生的一系列化学反应,图中“→”表示一种物质可以转化成另一种物质,请根据图示完成相关问题:

(1)铁钉由A变成B,实际上是铁与 等反应生成铁锈;
(2)图中反应②的化学方程式为 ;反应③的化学方程式为 。
(3)自选反应物,写出满足图中反应④的化学方程式 。
工业烟气脱硫就是将烟气中含有的二氧化硫除去。一种采用“双碱法”脱硫的工业流程示意图如图:
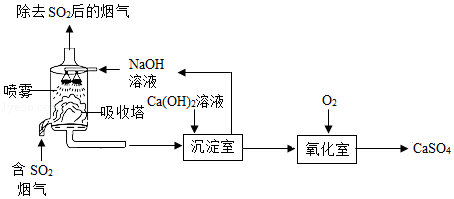
(1)吸收塔中,用NaOH溶液吸收SO2,生成 和H2O.NaOH溶液喷成雾状能充分吸收SO2的原因是 。
(2)沉淀室中,发生反应的化学方程式为 。
(3)氧化室中,化学反应的基本类型是 反应。
(4)上述流程中,可以循环利用的物质是 ,有利于节约成本。
某金属冶炼厂在生产过程中产生了一定量的含铜废料。化学兴趣小组利用稀硫酸和铁粉分离回收铜,并获得硫酸亚铁晶体。其设计方案如图1所示。

查阅资料得知:在通入空气并加热的条件下,铜可与稀硫酸反应转化为硫酸铜,反应的化学方程式:2Cu+2H 2SO 4+O 2  2CuSO 4+2H 2O。
2CuSO 4+2H 2O。
(1)步骤Ⅰ中分离得到固体A和蓝色溶液B的操作名称是 。
(2)蓝色溶液B中的溶质是 (填化学式)。
(3)写出步骤Ⅲ中发生反应的化学方程式 。
(4)硫酸亚铁可用作治疗 (选填"贫血症"或"佝偻病")的药物。
(5)铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu 2(OH) 2CO 3].根据铜锈的主要成分中含有氢元素和碳元素,可以判断出铜锈需要空气中的 (填化学式).若要探究"铜生锈是否需要空气中的氧气?"如图2所示实验中,只需完成 (填字母)两个实验即可达到实验目的。
侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工业流程大致如图:
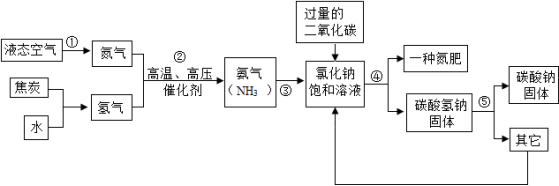
(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、 等.
(2)上述流程中,已知步骤②发生的是化合反应,步骤⑤发生的是分解反应,则步骤②、⑤发生反应的化学方程式是:② .
(3)上述流程中,可循环利用的物质是 .
(4)上述流程中,"一种氮肥"的化学式是 .
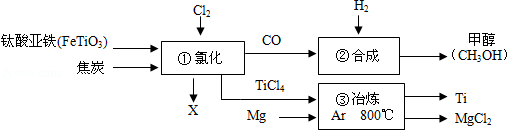
钛和钛合金被认为是21世纪的重要金属材料,被广泛用于火箭、导弹、航天飞机、船舶等,如图为某化工企业生成钛流程示意图:
请回答下列问题:
(1)FeTiO 3中钛元素的化合价为 ;
(2)①中化学方程式为2FeTiO 3+6C+7Cl 2  2X+2TiCl 4+6CO,则X为 (填化学式);
2X+2TiCl 4+6CO,则X为 (填化学式);
(3)②中CO和H 2以化学计量数1:2恰好完全反应,则该反应的基本反应类型是 ;
(4)③中氩气的作用是 ,该反应的化学方程式为 。
我国制碱工业的先驱侯德榜发明了"侯氏制碱法".其模拟流程如下:

(1)反应A、B、C中不涉及的基本反应类型是 ;
(2)"侯氏联合制碱法"的主要产品"碱"是指 (填化学式);
(3)反应B的化学方程式是 ;
(4)在该模拟流程中,能被循环利用的物质是 .
工业上以白云石(主要成分为CaCO3•MgCO3)为原料制备氢氧化镁的流程如图所示,请回答以下问题:

温馨提示:
①轻烧时温度低于700℃②MgCO3 MgO+CO2↑
MgO+CO2↑
③CaCO3 CaO+CO2↑ ④(NH4)2SO4+MgO
CaO+CO2↑ ④(NH4)2SO4+MgO MgSO4+2NH3↑+H2O
MgSO4+2NH3↑+H2O
(1)写出白云石轻烧后所得固体的主要成分 ;
(2)请分析流程中研磨的目的 ;
(3)写出流程中除水以外可以循环利用的物质 ;(写出一种)
(4)请分析如果轻烧时温度超过700℃对流程产生的影响。
利用某工业废弃固体(成分为Cu 2S和FeS 2)制备硫酸铜溶液和硫酸亚铁晶体,流程如图所示。
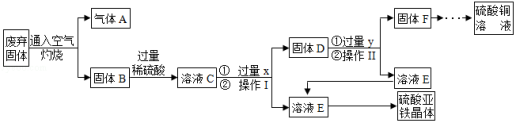
(已知:①固体B含有氧化铜、氧化铁②铁能与硫酸铁反应,生成硫酸亚铁)
(1)操作Ⅰ是 。为了提高废弃固体的反应速率,除将固体粉碎、提高温度外,还可以采取的具体措施有 (写一条)。
(2)写出FeS 2在空气中灼烧的化学方程式 。
(3)溶液C中的溶质有 (用化学式表示)。
(4)试剂y的作用是 。
试题篮
()