MgSO4•7H2O是一种重要的化工原料,某工厂以一种镁矿石(主要成分为SiO2和MgCO3,还含有少量FeCO3)为原料制备MgSO4•7H2O的主要流程如图:

已知:SiO2既不溶于水也不溶于稀硫酸。请回答下列问题:
(1)“操作a”的名称是 。
(2)“废渣Y”中含有少量的 FeOOH,其中铁元素的化合价是 。
(3)MgCO3溶于稀硫酸的化学方程式为 。
(4)“溶液A”中加入H2O2溶液会生成Fe2(SO4)3,该反应的化学方程式为 。
(5)选用MgO调节pH使Fe3+转化为沉淀,而不选用NaOH的原因是 。
从大理石(主要杂质是氧化铁)中提纯碳酸钙的一种实验流程如下:
(1)反应池I中用硝酸不用稀硫酸的主要原因是 。
(2)反应池Ⅱ中加入氨水的目的是 。
(3)反应池Ⅲ用生成碳酸钙的化学方程式是 。
(4)过滤Ⅱ中所得滤液在农业生产中的一种用途是 。
氯化钡是一种可溶性重金属盐,广泛应用于化工领域,其水溶液呈中性。工业上用毒重石(主要成分是 BaCO3)制备氯化钡晶体。某实验小组模拟工业上制备氯化钡晶体的流程,设计了实验室中制备氯化钡晶体的方案,实验流程如图所示。(该毒重石样品所含杂质难溶于水,不与酸反应。

(1)步骤①中发生反应的化学方程式为 。
(2)滤液Ⅱ是 30℃时氯化钡的 溶液(选填“饱和”或“不饱和”)。
(3)关于上述实验方案的相关内容,下列说法不正确的是 (选填字母序号)。
A、氯化钡是一种有毒的物质,使用时应注意安全
B、该实验流程中得到的副产品二氧化碳是重要的化工原料
C、可用重晶石(主要成分是硫酸钡)代替该实验流程中的毒重石,制备氯化钡晶体
D、步骤②将滤渣进行水洗,既能提高氯化钡晶体的产率,又能减少 Ba2+环境的污染
(4)某同学提出,步骤③将滤液Ⅰ浓缩时会产生气体污染物,其化学式为 。为防止污染,需要对滤液Ⅰ处理后再浓缩。简述处理滤液Ⅰ的方法: 。
镁元素广泛应用于火箭、导弹和飞机制造业,被称为“国防元素”。如图1所示为制取单质镁的转化过程,试回答下列问题:
如图转化过程中发生的化学反应主要有:

MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl═MgCl2+2H2O,MgCl2 Mg+Cl2↑
(1)在过程①中,所加石灰乳的主要成分是 (填写化学式)。
(2)过程②所发生的反应属于 (填“化合”“分解”“置换”或“复分解”)反应。
(3)下列有关过程③中能量转化的说法,正确的是 (填选项序号)。
A.电能转化为化学能 B.化学能转化为电能 C.潮汐能转化为化学能
(4)海水或卤水中本来就含有氯化镁,还需要过程①②的原因是 (选项序号)。
A.将氯化镁富集提纯 B.生成更多氯化镁 C.使石灰乳和稀盐酸反应
(5)某化学兴趣小组欲测定某氯化镁样品中MgCl2的含量(杂质为NaCl),称取10g该样品将其置于干净的烧杯中,加入适量水,使固体样品完全溶解。向所得溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与滴入NaOH溶液的质量关系如图所示。试回答下列问题:

①当滴入NaOH溶液120g时(即图中B点),烧杯中溶液里含有的溶质为 (写化学式)。
②当滴入10%的NaOH溶液80g时(即图中A点),恰好完全反应,试通过计算,求10g此氯化镁样品中MgCl2的质量。(计算结果精确至0.1g)
水是生命之源,水和溶液在日常生活、工农业生产中有着重要的意义。
(1)现有蒸馏水和硬水各一杯,区分两者应选用的试剂为 。
(2)夏季空调冷气吹到的地方可以看到“冷气雾”。试从微观角度解释这一现象 。
(3)某种水培植物所需营养液中含有K+、NH4+、NO3﹣、PO43﹣,若用两种溶质配制该营养液,可选用钾肥的化学式为 (任填一种)。
(4)盐酸左氧氟沙星是常用抗菌药物,其注射液溶质质量分数不超过10%,若每瓶含盐酸左氧氟沙星固体0.4g,则使用时至少需加入生理盐水 mL(密度约为1g/mL)。
(5)工业从卤水(海水晒盐后的母液,含有MgCl2、NaCl、MgSO4、KCl)中提取KCl的流程示意图如图1所示

根据图2溶解度曲线信息,晶体A中含有的物质化学式为 和 ,用冷水冲洗晶体C的目的是除去 (填化学式)。
某课外研究小组,用废弃的黄铜(铜锌合金),通过两种途径制取硫酸铜晶体。实验流程如图所示:

(1)操作a为 ,该操作中用到的玻璃仪器有烧杯、 、玻璃棒。
(2)浓硫酸是化学实验室里一种常见的酸。
①实验室稀释浓硫酸的操作是:将 ,并用玻璃棒不断搅拌。
②化学实验应高度关注安全问题。若不慎将少量浓硫酸沾到皮肤上,应先用大量水冲洗,再涂 溶液。
(3)如图2是实验室用过氧化氢溶液和二氧化锰制取氧气的装置。
①主要实验操作步骤有:
a.收集气体 b.检查装置气密性 c.将二氧化锰放入锥形瓶中 d.从长颈漏斗中注入过氧化氢溶液
正确的操作顺序是 (写字母序号)。
②在实验过程中,某同学因加入的药品量不足,致使集气瓶内剩余少量水。若想集满这瓶氧气,在不拆卸装置和不添加药品的前提下,请帮他想出种解决的方法 。
(4)操作b的顺序为蒸发浓缩、 过滤、干燥。
(5)下列测定稀硫酸pH的操作正确的是 (写字母序号)。
A.将pH试纸直接插入稀硫酸中
B.先将pH试纸用蒸馏水润湿
C.用玻璃棒蘸取少量稀硫酸,滴在pH试纸上
D.根据试纸显示的颜色估算出溶液的pH

侯德榜是我国著名的化学家,发明了侯氏制碱法,为纯碱和氮肥工业技术的发展作出了杰出的贡献。工业上以半水煤气(主要成分是N2、H2、CO、CO2和H2O)、食盐等为原料制取纯碱的流程如下:

(1)流程中循环利用的物质有H2O和 。
(2)步骤Ⅰ中,在使用铜催化剂和加热条件下,半水煤气主要成分间发生反应实现了CO转化,化学方程式是 。
(3)实验室从混合气体H2、N2、CO2中分离出CO2的实验装置如图所示。广口瓶和分液漏斗中盛放的药品分别是 、 。
(4)除去纯碱中少量碳酸氢钠杂质的方法是 。
(5)纯碱用途广泛。工业上可用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3,达到减少污染、节约资源的目的。反应过程中溶液组成变化如图3所示。
①吸收初期(图中A点以前)反应的化学方程式为 。
②不断通入SO2,最终产物是 。

氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:
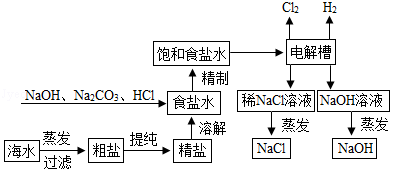
(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是 (填名称)
22等物质,“精制”过程中加入NaOH的目的是 。
(3)写出“电解槽“中发生反应的化学方程式 ,流程中可以循环使用的物质有 (填化学式)
23和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
等级 |
氢氧化钠含量 |
碳酸钠含量 |
优等品 |
≥99.0% |
≤0.5% |
一等品 |
≥98.5% |
≤0.8% |
合格品 |
≥98.0% |
≤1.0% |
23的原因是 23,下列试剂中可选择使用的是
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是 (不考虑其他杂质参加反应)
我国古代曾用“地糠法”制取Cl2,两用Cl2与石灰乳反应生产漂白粉,流程如下:

已知:漂白粉的有效成分是Ca(ClO)2,Ca(ClO)2的化学名称叫做次氯酸钙。Ca(ClO)2中,氯元素的化合价为+1价。请回答下列问题:
(1)HCl与O2反应的化学方程式为 ,该反应所属的基本反应类型为 。
(2)Ca(ClO)2在物质的分类上属于 。
A.氧化物 B.酸 C.碱 D.盐
(3)“84消毒液”(主要成分为次氯酸钠)与“洁厕灵”(主要成分为盐酸) 不能混合使用,否则会产生氯气使人中毒。请写出次氯酸钠的化学式 。
(4)石灰乳 (填“属于”或“不属于”)溶液。
某兴趣小组在实验室模拟水厂将浑浊的湘江水净化成自来水,并最终制成蒸馏水,其实验流程如图所示:

请回答下列问题:
(1)加入明矾的作用是 ;操作1的名称是 。
(2)利用如图所示的装置进行操作2,此操作的作用是 待处理的水应该从 端通入(填"a"或"b"),理由是 。

(3)取少量的液体D于试管中,滴入肥皂水振荡,发现有较多的浮渣产生,说明此液体为 (填"软水"或"硬水"),生活中常用 的方法软化硬水。
(4)通过操作3可以得到净化程度较高的蒸馏水,操作3的名称是 。
工业上用闪锌矿(主要含ZnS,还有PbS等杂质)制备Zn,并将产生的废气转换成工业原料,设计流程如图(部分产物略去)。

(1)X的化学式 ,图中用过量空气的目的是 ;
(2)①~ ④中属于化合反应的是 ;
(3)Zn (填“能”或“不能”)与氯化铅(PbCl2)溶液反应;
(4)写出③中生成ZnO的化学方程式 ,产生的工业废气SO2在一定条件下与氧气化合生成的Z物质是 (填化学式)。
工业上生产纯碱的部分工艺如下:

反应原理是①NaCl+H2O+NH3+CO2═NH4Cl+NaHCO3↓
②2NaHCO3 Na2CO3+H2O+CO2↑
某兴趣小组设计了如下装置在实验室模拟该制碱过程,分析并回答问题。

(1)装置C中发生反应的化学方程式是 。
(2)B中导气管的作用是 。
(3)反应原理②的实验可在 (填字母)装置中进行。
(4)反应过程中的副产品NH4Cl是农业上常用的 (填肥料种类)。
据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。某种手机电路板中含有以下金属:Sn、Pb、Fe、Cu、Au、Ag、Ni(镍,银白色)、Pd(钯,银白色)。如图是某工厂回收其中部分金属的流程图。(假设流程图中各反应均恰好完全反应。已知:2Cu+O2+2H2SO4 2CuSO4+2H2O)
2CuSO4+2H2O)
(1)步骤②中产生的气体是 。
(2)滤渣2中含有的金属是 。
(3)步骤⑤反应的化学方程式 。
(4)步骤⑥回收的纯净物B是 (写化学式)。
(5)金属Fe、Ni、Pd在溶液中的活动性由强到弱的顺序依次是 。

氧化锌广泛用于皮肤病的治疗,工业氧化锌常含有少量杂质(CuO、FeO、SiO2等)不能直接使用。提纯、净化氧化锌的简易流程如图所示:

参考资料:SiO2既不溶于水也不与酸反应
(1)反应器Ⅰ中加入足量稀硫酸,充分反应后,生成硫酸盐的化学式为 ;
(2)残渣中除金属锌外,还有 ;
(3)操作一、操作二和操作三采用的分离方法是 ;
(4)操作四发生反应的化学方程式为 。
试题篮
()