内江拥有中国西南地区最大的再生资源基地,可回收处理大量废旧塑料电器及玻璃等,某品牌电器的废旧电路板中含有Fe、Cu、Ag、Ni(镍,银白色金属) 等金属,如下图是某车间回收部分金属的工艺流程。已知,2Cu+O2+2H2SO4 2CuSO4+2H2O。
2CuSO4+2H2O。
回答下列问题。
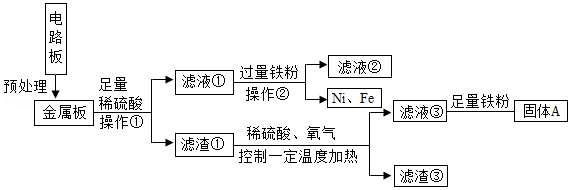
(1)操作①中,使用的玻璃仪器除烧杯、玻璃棒外,还需 ;
(2)滤渣③中含有的金属是 ;
(3)根据以上工艺流程图,可以得出Ni、Fe的金属活动性强弱顺序是Ni Fe(填“>”或“<”)。
(4)滤液③中加入足量铁粉的主要目的是 ,固体A除主要含有铜外,还含有一定量的铁,为了进一步提纯铜,可以向固体A中加入适量的稀硫酸,发生反应的化学方程式为 ;
(5)相比于直接焚烧废旧电路板回收金属,该工艺流程的主要优点是 。
辉铜矿的主要成分为硫化亚铜(Cu2S),工业上用辉铜矿冶铜的一种工艺流程图如下:
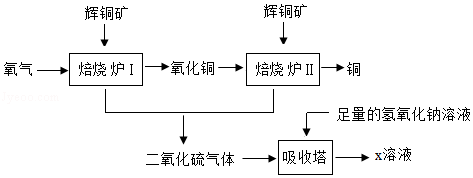
请你回答下列有关问题:
(1)硫化亚铜中铜元素的化合价为 。
(2)焙烧炉Ⅱ中发生反应的化学方程式为 。
(3)二氧化硫与二氧化碳具有相似的化学性质,则x溶液中盐的化学式是 。
某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示:

已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。
(1)烟泥最初处理需要除油污,用洗涤剂除油污的过程中发生了 现象。步骤①产生的废气B中,一定含有的有害气体是 (填化学式)。环保处理最好釆用的试剂是 (填字母序号)。
A、浓硫酸 B、食盐水 C、石灰乳
(2)写出步骤④中得到铜的化学方程式 ,它属于基本反应类型中的 反应。
(3)步骤③和④中主要操作的名称是 。
(4)我国古代就制得了一种外观似金子的锌和铜的合金,也就是黄铜,它的硬度比纯铜 (填“高”或者“低”)。
(5)取少量的溶液C,往其中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。往滤渣中加入稀盐酸有气泡产生,则滤液中一定没有 (填字母序号)。
A、硫酸镁 B、硫酸锌 C、硫酸铜 D、硫酸铜和硫酸锌
某班同学在实验室完成实验探究后得到废液A,其中含有稀硫酸、硫酸亚铁和硫酸铜。老师将同学们分成甲乙两组,继续进行如下实验,请完成下列相关问题:
[甲组任务]将废液转化成硫酸亚铁晶体。实验流程如图
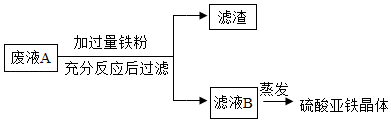
(1)滤液B中的溶质来自于哪几个部分?
(2)写出上述流程中的一个化学反应方程式: 。
[乙组任务]利用废液来探究金属铝的化学性质。实验流程如图: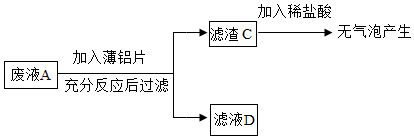
(3)滤渣C中一定没有 。
(4)滤液D中一定含有的溶质是 (填化学式,下同),可能含有的溶质是 。
汽车给人们的生活带来方便的同时,也带来节能和减排的问题。如图是某种汽车的燃料燃烧过程示意图
(1)从燃烧的条件看,火花塞的作用是 。
(2)将汽油与空气的混合气充分压缩,有助于节省燃料,说明主要原因。
(3)乙醇的含碳量比汽油的低。分析在汽油中加入适量乙醇,对尾气中炭黑排放量的影响。
(4)利用催化净化装置,可使燃烧过程中产生的CO和NO在催化剂的作用下,转化为两种空气中常见的无害气体,该反应的化学方程式为 。
金属及其化合物在生产生活中有广泛的应用。

(一)金属的应用和防护
(1)用不锈钢、合成橡胶、氧化镁等材料制造的飞机轮胎属于 材料。
(2)航空煤油是飞机的燃料,它主要是由 炼制的。
(3)铁易生锈,提出防止铁生锈的一种方法 。
(4)特种钢中含有少量Mn、MnO2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为 。
(5)Mg(OH)2受热分解生成高熔点的MgO.Mg(OH)2可用作阻燃剂,其主要原理是 (选填序号)。
a.分解吸热,降低可燃物着火点 b.MgO覆盖燃烧物,隔绝氧气
(二)制备还原性铁粉
实验室利用废铁屑(含少量Fe2O3)为原料制备还原性铁粉的流程如下:
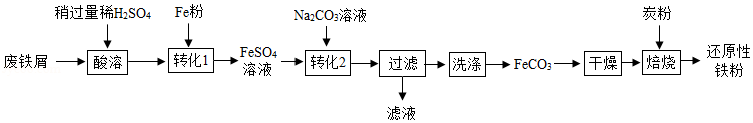
(1)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该反应的化学方程式为 。
(2)检验FeCO3已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加 溶液,无明显现象。
(3)“干燥”时有少量FeCO3发生下列转化:FeCO3 FeOOH+CO2,该转化的化学方程式为 。
(4)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是 。
(三)测定还原性铁粉的组成
还原性铁粉中含有少量FexCy,小组同学在老师的指导下进行以下实验。
资料:①Fe,FexCy在加热时与O2反应能生成相应氧化物。
②FexCy不与酸反应。
实验1:取29.52g样品,加入足量稀H2SO4,充分反应后生成1.00gH2。
实验2:另取29.52g样品,按如图进行实验。
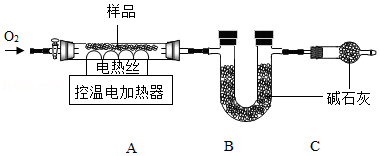
表:装置A和B的质量变化
装置 |
A |
B |
反应前 |
300.00 |
400.00 |
反应后 |
m |
400.44 |
实验后A中固体全部变为红棕色,装置A、B的质量变化如上表。
(1)装配好装置后,实验前先要 。
(2)装置C的作用是 。
(3)FexCy中,x:y= 。表中m的值是 。
反思:若用空气替代O2进行实验,测得x:y的值偏大,可能的原因是 。
水产养殖的速效增氧剂“鱼浮灵”的主要成分是过氧碳酸钠(aNa2CO3•bH2O2)。
某化学研究小组对“鱼浮灵”的制备、成分测定及增氧原理进行了如下探究。
【查阅资料】①过氧碳酸钠有Na2CO3和H2O2的双重性质;50℃开始分解。
②过氧碳酸钠在异丙醇(有机溶剂)中的溶解度较低。
Ⅰ.“鱼浮灵”的制备。
实验室用Na2CO3与稳定剂的混合溶液和30%的H2O2溶液反应制备过氧碳酸钠,实验装置如图所示。

(1)反应温度不能超过20℃的原因是 。
(2)反应结束后,停止搅拌,向反应液中加入异丙醇,静置过滤、洗涤、干燥,获得过氧碳酸钠固体。加入异丙醇的目的 。
Ⅱ.“鱼浮灵”的成分测定。
【定性检测】检测过氧碳酸钠溶液中的成分。
(3)请补充完成下列实验报告中的相关内容。
实验序号 |
实验步骤 |
实验现象 |
解释或结论 |
① |
取样,加入MnO2粉末,用带火星的木条伸入试管内 |
木条复燃 |
反应的化学方程式
|
② |
|
|
溶液中含有Na2CO3 |
【定量研究】测定“鱼浮灵”中过氧碳酸钠的组成。
实验③:称取一定质量的“鱼浮灵”样品于小烧杯中,加适量水溶解,向小烧杯中加入足量Ba(OH)2溶液,过滤、洗涤、干燥,得到碳酸钡(BaCO3)固体3.94g。
实验④:另称取相同质量的“鱼浮灵”样品于锥形瓶中,加入足量稀硫酸,再逐滴加入高锰酸钾溶液,充分反应,消耗KMnO4的质量为1.896g,该反应的原理是:2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O。
(4)计算确定过氧碳酸钠(aNa2CO3•bH2O2)的化学式(写出计算过程)。
Ⅲ.“鱼浮灵”的增氧原理。
研究小组通过测定常温下相同时间内水溶液中溶解氧的变化,探究CO32﹣、OH﹣对H2O2分解速率的影响,设计了对比实验,实验数据记录如下表。
编号 |
① |
② |
③ |
④ |
⑤ |
试剂 |
H2O |
4%H2O2溶液 |
Na2CO3固体 4%H2O2溶液 |
NaOH溶液 4%H2O2溶液 |
NaOH溶液 4%H2O2溶液 |
pH |
6.96 |
6.01 |
8.14 |
8.15 |
9.26 |
溶解氧 (mg•L﹣1) |
5.68 |
6.44 |
9.11 |
9.12 |
10.97 |
(5)由实验②可知,常温下,过氧化氢水溶液呈 (填“酸性”“中性”或“碱性”)。
(6)过氧碳酸钠可以速效增氧的原理是 。
钛(Ti)被称为“航空金属”。由钛铁矿(主要成今是钛酸亚铁,化学式为FeTiO3)制备钛的一种流程如下:

(1)FeTiO3中钛元素的化合价为 。
(2)“氯化”过程中焦炭的作用是 。
(3)由TiCl4制备Ti的化学方程式为 。该反应在氩气(Ar)氛围中进行的理由是 。
(4)如上述流程所示,将钛厂、氯碱厂和甲醇厂组成产业链的好处是 。
钼是一种重要的金属,用它制成的合金有良好的机械性能,在工农业生产和国防上都有广泛的用途。如图是利用钼矿石(主要成分为MoS 2)制备金属钼的流程图:
信息:MoO 3+3H 2 Mo+3H 2O

请回答下列问题:
(1)反应①常将钼矿石粉碎,目的是 ;MoO 3中钼元素的化合价为 。
(2)操作Ⅰ的名称是 ;常用NaOH溶液吸收反应①的尾气,化学方程式为 。
(3)制得19.2吨金属钼,理论上至少需含MoO 380%的粗产品多少吨?请写出计算过程。
注:粗产品杂质中不含钼元素
教育部从2018年开始,要求在学校普及垃圾分类回收处理的相关知识。某化学活动小组结合所学的知识对此进行一系列实践活动。
Ⅰ.活动探究
(1)学会识图分拣垃圾:下列垃圾应投入带有如图图标的垃圾箱内的是 (填字母序号)。
| A. |
塑料瓶 |
| B. |
果皮 |
| C. |
碎瓷片 |
(2)学会检验有害气体:含氯塑料焚烧时会产生氯化氢等气体。若要检验焚烧后的气体中有氯化氢,可将其通入 溶液中,有白色沉淀生成即可。
Ⅱ.实验探究:
[提出问题]如何回收处理废旧电池中的镉?
[查阅资料]
(1)废旧电池中含有镉、汞等元素,这些元素会危害人类健康。
(2)镉(Cd)从溶液中析出时呈海绵状固体。在化合物中通常表现为+2价。
(3)碳酸镉(CdCO 3)、氢氧化镉[Cd(OH) 2]都是白色固体、难溶于水。
[设计实验]先将废旧电池进行处理以制得硫酸镉( CdSO 4)溶液,用于以下实验。
| 实验设计 |
实验步骤 |
实验现象 |
实验结论 |
| 与金属反应 |
取少许溶液于试管中,加入足量的Zn粉,充分反应。 |
|
Zn可以置换出Cd |
| 与碱反应 |
取少许溶液于试管中,加入足量的NaOH溶液,充分反应。 |
产生白色沉淀 |
用化学方程式表示为 。 |
| 与盐反应 |
取少许溶液于试管中,加入足量的 溶液,充分反应。 |
产生白色沉淀 |
可用该试剂除去CdSO 4. |
[回收处理]
实验结束后,将反应后的混合物通过过滤、洗涤、加热,进而再制得镉。
[交流反思]
请同学们基于化学视角说明垃圾分类回收处理的重要意义 (答一点即可)。

自然界并不缺少镁,缺少的是发现镁的眼睛。某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
(1)第一站:初识金属镁。①金属镁的物理性质: (写一条);②金属镁的化学性质:镁能与氧气反应,反应的化学方程式为 。
(2)第二站:再遇金属镁。将打磨过的镁条放入稀盐酸中,反应现象是 ,化学方程式为 。
(3)第三站:制备金属镁。小组同学模拟工业上从海水晒盐剩下的苦卤中提取镁,流程如下:
苦卤 Mg(OH)2 MgCl2 Mg,流程中X为 。
(4)第四站:再探金属镁。
[提出问题]镁能否与热水反应?如果反应,产物是什么?
[相关信息]①Mg+2H2O=Mg(OH)2+H2↑;②氢氧化镁在热水中能部分溶解。
实验操作 |
实验现象 |
实验结论 |
① ② |
① ② |
镁能与热水反应,生成氢氧化镁和氢气 |
(5)上述寻镁之旅中你收获到镁的化学性质有 。
氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:
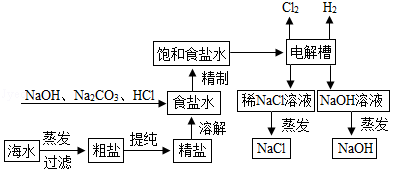
(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是 (填名称)
(2)“食盐水”中常含有NaCl、MgCl2、CaCl2等物质,“精制”过程中加入NaOH的目的是 。
(3)写出“电解槽“中发生反应的化学方程式 ,流程中可以循环使用的物质有 (填化学式)
(4)氯碱工业生产的碱样品中常含有Na2CO3和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
等级 |
氢氧化钠含量 |
碳酸钠含量 |
优等品 |
≥99.0% |
≤0.5% |
一等品 |
≥98.5% |
≤0.8% |
合格品 |
≥98.0% |
≤1.0% |
①你认为碱样品中含有Na2CO3的原因是 ,检验碱样品中是否含有Na2CO3,下列试剂中可选择使用的是
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
称取20.3g碱样品,加足量水溶解,再加入足量的氯化钡溶液,充分反应后,过滤得到滤渣和滤液;将滤渣洗涤,干燥得到碳酸钡(BaCO3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是 (不考虑其他杂质参加反应)
硫酸亚锡(SnSO4)广泛应用于电镀工业。该物质易与氧气反应而变质。实验室模拟工业上制取SnSO4的一种实验方案如下:

(1)SnCl2由Sn与盐酸反应制得,同时生成氢气,该反应的化学方程式为 ↑ 。
(2)Na2CO3俗称 。
(3)过滤所得滤液中的溶质为 (填化学式)。
(4)用已知质量分数和密度的浓硫酸配制质量分数为15%的稀硫酸,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和 。稀释浓硫酸的正确操作为 。
(5)反应2属于基本反应类型中的 反应。从反应2所得溶液中获得SnSO4晶体的部分操作须在隔绝空气条件下进行的原因是 。
化学在改善人类生存环境,提高生活质量方面起着重要作用。
[改善环境]温室效应和酸雨会威胁珊瑚礁生存,我国开展了南海珊瑚礁生态修复工作。
(1)我们把pH (填“>”、“<”成“=”)5.6的降雨称为酸雨。
(2)为改善生存环境,倡导“低碳”生活,建议使用清洁能源。写出一种常见的清洁能源 。
[探测资源]近期,我国向月球背面成功发射一颗中继通信卫星,助力探测月球资源。
(1)月球上有丰富的核能原料He﹣3,He的原子结构示意图为 (填字母序号)
(2)月球土壤中有天然的铁、铅、银等金属颗粒。根据铁锈蚀的条件分析,铁在月球上不易锈蚀的原因可能是 。
[研发材料]中国芯彰显中国“智”造,芯片的基材主要是高纯硅。
(1)硅元素在元素周期表中的信息如图2所示,据图可得到的信息是 (填字母序号)

A.硅元素是非金属元素
B.硅元素的元素符号为Si
(2)如图是一种制备高纯硅的工艺流程图:

[查阅资料]常温下,氯化镁溶液呈中性。
①反应I的化学方程式:2Mg+SiO2 Si+2MgO,该反应属于 反应(填基本反应类型)。反应Ⅱ要在无氧气环境中进行,原因是 (答出一种即可)。
Si+2MgO,该反应属于 反应(填基本反应类型)。反应Ⅱ要在无氧气环境中进行,原因是 (答出一种即可)。
②操作I的名称是过滤,过滤时液面应 (填“高于”或“低于”)滤纸边缘。所得粗硅应充分洗涤,以除去表面可能含有的盐酸、 、(填化学式)。
③简要叙述检验盐酸已过量的方法 。
④上述已知生产流程中,可以循环利用的物质是 (填化学式)。
碳酸钠广泛用于造纸、纺织、玻璃、洗涤剂、肥皂、制革等工业,是一种重要的化工原料。吕布兰、索尔维和侯德榜为碳酸钠的工业化生产作出了巨大贡献。
I、吕布兰法
1789年,法国医生吕布兰(N.Leblanc,1742﹣1806)以食盐、浓硫酸、木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如图:

(1)碳酸钠俗称 。
(2)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为
(3)③中“水浸”时通常需要搅拌,其目的是
(4)不断有科学家对吕布兰法进行改进,是因为此法有明显不足,请写出一条不足之处 。
Ⅱ、索尔维法
1892年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。原理如下:
NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。

实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min |
t0 |
t1 |
t2 |
t3 |
t4 |
t5 |
剩余固体质量/g |
未记录 |
15.3 |
13.7 |
11.9 |
10.6 |
10.6 |
请回答下列问题:
(5)饱和 NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为 ;
(6)三颈烧瓶上连接的长颈漏斗的主要作用是 ,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是 ;关闭K2停止通NH3后,还要继续通一段时间CO2,其目的是 ;
(7)根据实验记录,计算t2时 NaHCO3固体的分解率(已分解的 NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程。
若加热前 NaHCO3固体中还存在少量NaCl,上述计算结果将 (填“偏大”、“偏小或“无影响”)。
(8)制碱技术在很长一段时间内把持在英、法等西方国家手中,我国化学工程专家侯德榜先生独立摸索出索尔维法并公布与众,又于1943年创造性地将制碱与制氨两种工艺联合起来,基本消除废弃物的排放,同时生产出碳酸钠和氯化铵两种产品,这就是著名的侯氏制碱法。下列认识或理解正确的是
①科学认识是在曲折的、艰辛的积累过程中不断进步的;
②“科技兴邦、实业救国”是侯德榜先生回国研究的巨大动力;
③侯氏制碱法大大提高了原料的利用率,它符合当今“绿色化学”的理念。
试题篮
()