目前,农业上使用最多的氮肥主要有尿素、硝酸铵和碳酸氢铵等,其中硝酸铵的生产原理是利用氨催化氧化得到的硝酸,再跟氨反应生产硝酸铵,基本流程如下:

已知:①上述流程图中A、B、C均为气体,其中A、B为单质且A的相对分子质量为28,C为含有A组成元素的化合物;氨与氧气反应的条件是高温、催化剂。
②在化学反应中,只要有物质所含元素的化合价发生了变化的反应就是氧化还原反应。例如:2Na+2H 2O═2NaOH+H 2↑,反应前后,Na元素、H元素的化合价分别发生了变化,该反应是氧化还原反应。
请回答下列问题:
(1)写出A、C两种物质的化学式:A为 ;C为 。
(2)NH 3和O 2反应的化学方程式为
(3)上述流程图的5个反应中有 个属于氧化还原反应。
为了将混有硫酸钾、氯化钙、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钾提纯,并制得纯净的氯化钾溶液,某同学设计的实验流程如下

请根据以上流程图中的信息.回答下列问题:
(1)步骤①中除去碳酸氢铵的方法是 ;
(2)步骤④中加过量碳酸钾溶液的目的是 ;
(3)此设计方案是否严谨?并说明理由 .
我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:

【小资料】
I、贝壳的主要成分是CaCO3
Ⅱ、通常情况下,1体积水中大约能溶解700体积氨气,1体积水中大约能溶解1体积二氧化碳
Ⅲ、饱和食盐水中发生的主要反应为:NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl
(1)合成氨需要的氮气来自空气,空气属于 (填“混合物”或“纯净物”)。空气中氮气的体积分数约为 。
(2)过程②中主要操作的名称是 。
(3)过程①中发生反应的化学方程式为 ,过程③中反应所属基本反应类型为 。
(4)为了提高产率,往饱和食盐水中通入气体时,你认为应该先通入 (填“NH3”或“CO2”),你的理由是: 。
(5)上述流程中可以循环利用的物质是: (填化学式)
实验室有氧化铜和铁的混合粉末,为提炼其中的铜,取等质量样品,分别进行了两个实验。
实验一

①分离得到溶液C的操作名称是 。
②写出步骤II中反应的化学方程式 。
③上述步骤 (选填步骤编号)所包含的反应体现了铁的活动性比铜强。
实验二

④写出步骤Ⅳ中反应的化学方程式 。
⑤D、E是同一种溶质形成的溶液,请写出该溶质的名称,判断能否得出D、E溶液中该溶质质量的大小关系并说明理由。
海水晒盐得到粗盐,剩余的母液称为苦卤,粗盐和苦卤用途广泛.
2+2+42﹣22323溶液的目的是 .
(2)利用苦卤制取镁,主要流程如图:

步骤Ⅱ中的试剂a是 .步骤Ⅰ中反应的化学方程式是 .
(3)采用氨碱法生产纯碱,主要流程如图:

①上述Ⅰ、Ⅱ两个步骤总反应的化学方程式是 .
②从步骤Ⅱ过滤后的滤液中可获得铵态氮肥.检验铵态氮肥的方法是 .
海水中有着丰富的化学资源,人们可以从海水中提取出很多的物质,如:氯化钠、镁等.如图就是利用海水提取氯化钠的大致过程:

(1)图中①是 (填“蒸发池”或“冷却池”);
(2)析出晶体后的母液是氯化钠的 (填“饱和溶液”或“不饱和溶液”);
(3)实验室除去粗盐中难溶性杂质的主要实验步骤有:
Ⅰ溶解Ⅱ (填操作名称)Ⅲ蒸发
(4)提取粗盐后的母液中含有较多氯化镁,从母液中提取金属镁的过程大致如下:

该过程中反应Ⅰ的基本反应类型是 ;
写出反应Ⅱ的化学方程式为 .
通过化学变化可以制备物质。
(1)某兴趣小组欲用200g 4%的氢氧化钠溶液吸收二氧化碳制备碳酸钠,反应的化学方程式是 ;若要将提供的氢氧化钠全部转化为碳酸钠,请列出计算需二氧化碳质量(x)的比例式 ;
(2)在实验中,该小组同学发现,要定量控制通入氢氧化钠溶液中二氧化碳气体的质量,难以操作。请分析若通入二氧化碳气体的量不足时会导致产物中混有的杂质是 ;
(3)查阅资料:
Na2CO3+CO2+H2O=2NaHCO3;
NaHCO3+NaOH=Na2CO3+H2O;
该小组同学将制备方案改进如下:
步骤 |
实验操作 |
实验目的 |
一 |
将200g 4%的NaOH溶液分为两等份 |
/ |
二 |
① |
将其中一份溶液中的NaOH全部转化为NaHCO3 |
三 |
将步骤二所得溶液小心煮沸1﹣2分钟 |
② |
四 |
③ |
将NaHCO3全部转化为Na2CO3 |
(4)假设每步转化都完全,该小组同学利用改进后的方案制取的碳酸钠质量m1= g;经老师指导,该小组同学将步骤四反应后的溶液蒸干并充分灼烧得到碳酸钠粉末的质量为m2g,发现m1=m2,由此证明他们的方案改进成功。
某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:

已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣Ⅰ中一定有 。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是 。此过程中Zn还能起到除铜作用,除铜的化学方程式为 ,此反应属 (填基本反应类型)。
(3)调节pH可用NaOH,但不能过量,其原因是 。
(4)焙烧Zn(OH)2发生分解反应的化学方程式为 。
氨气(NH 3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,氨水显碱性.实验室里加热氯化铵(NH 4Cl)和熟石灰两种固体的混合物可制取氨气,同时生成氯化钙和水.
(1)下列装置是实验室制取气体的一些发生装置,a仪器为 ,b仪器为 .制取二氧化碳的发生装置是 (填字母序号);制取氨气的发生装置是 (填字母序号),收集氨气的方法是 .
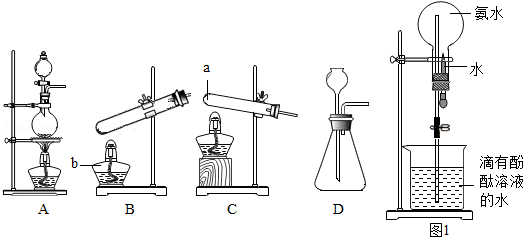
(2)图1是氨气的喷泉实验装置.打开橡皮管上的夹子,将胶头滴管中的水挤入盛满干燥氨气的烧瓶中,因为氨气极易溶于水,烧瓶内的压强降低,烧杯中的水就会进入烧瓶,形成 色的喷泉.
(3)当喷泉实验结束后,测烧瓶内溶液的pH.
步骤如下:
步骤一:用手撕一小段pH试纸,放到干净的玻璃片上.
步骤二:用蒸馏水润湿pH试纸.
步骤三:用玻璃棒蘸取待测液滴到pH试纸上.
步骤四:把试纸显示的颜色与标准比色卡对比,读取pH.
该实验步骤有几处错误? 处,请改正: .
某工厂产生的废水中含有硫酸锌和少量的硫酸铜以及污泥,为了变废为宝,利用废水制取七水硫酸锌( ZnSO 4•7H 2O),其工艺流程图如下:

回答下列问题:
(1)步骤①的操作名称 .
(2)步骤②需如入过量的物质是 ,目的是 .
(3)步骤③需加入的溶液是 .
(4)步骤④的操作是蒸发浓缩, ,过滤.
(5)如果用ZnSO 4•7H 2O来配制100g 32.2%的硫酸锌溶液,需要 g七水硫酸锌.
日常生活中使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所填充,其结构如图1所示。某学校化学兴趣小组的同学准备从废旧的干电池中分离出二氧化锰,并制备硫酸锌固体。
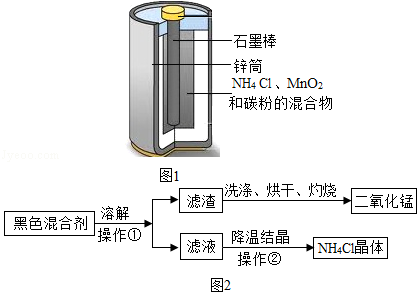
Ⅰ:设计回收二氧化锰的流程如图2所示:
(1)操作①和操作②的名称都是 ,该操作中玻璃棒的作用是 。
(2)上述操作中灼烧滤渣的目的是 。
(3)为了有效回收、利用二氧化锰,小茗同学用回收的二氧化锰与双氧水来制取氧气,请你写出该反应的化学方程式 。
Ⅱ:制备硫酸锌固体的实验步骤:
①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应
②将滤液加热浓缩,得到热的饱和溶液
③将上述反应后的混合物过滤
④降温结晶
⑤过滤,得到ZnSO 4•7H 2O晶体
(1)正确的实验操作顺序为(填序号) 。
(2)步骤①中反应的化学方程式 。
Ⅲ:废旧干电池随意丢弃会造成环境污染。请你指出对废旧干电池的处理意见(只填一条): 。
回收利用是保护金属资源的一条有效途径,某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液.主要流程如图:

已知:CuO+H 2SO 4═CuSO 4+H 2O Fe+Fe 2(SO 4) 3═3FeSO 4
(1)流程Ⅰ中氧化铁发生反应的化学方程式是 .
(2)流程Ⅲ充分反应后,还应有的实验操作是 .
(3)A﹣E中,含有铁、铜两种元素的是 (填字母).
碱式碳酸镁[Mg2(OH)2CO3]和过氧化镁(MgO2)都是重要化工原料。
Ⅰ.以Mg2(OH)2CO3为原料,制备产品MgO2的步骤如下:
(1)煅烧:煅烧Mg2(OH)2CO3得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水变浑浊,煅烧时反应的化学方程式为 。
(2)转化:向所得固体中加双氧水充分搅拌,发生反应MgO+H2O2=MgO2+H2O,温度升高,说明该反应 热量(填“放出”或“吸收”)。其他条件相同,煅烧温度、煅烧时间不同,所得MgO对MgO2产率(产率= ×100%)的影响分别如图1所示,则最佳的煅烧温度为 ℃、煅烧时间为 小时。
×100%)的影响分别如图1所示,则最佳的煅烧温度为 ℃、煅烧时间为 小时。

(3)分离:得到产品。
(4)测定:假设产品中仅少量MgO,某小组设计图2装置,通过测定生成O2体积,计算MgO2的质量分数。
已知:a.MnO2与稀盐酸不反应 b.MgO2+2HCl=MgCl2+H2O2
c.2MgO2 2MgO+O2↑ d.MgO+C
2MgO+O2↑ d.MgO+C Mg+CO↑
Mg+CO↑
①仪器M的名称是 ,MnO2的作用是 。
②相同条件下, 能使测定结果更准确。(填图2中“装置A”或“装置B”)
③实验室用溶质质量分数为37%、密度是1.18g•mL-1的浓盐酸配制10%的稀盐酸110g,需要水 mL.(水的密度是1g•mL﹣1,计算结果保留一位小数)
④经讨论,该小组又设计了下列3种方案,分别取5.0g产品进行实验,能确定MgO2质量分数的是 。(填序号)
a.加热,使MgO2完全分解,测出剩余固体的质量
b.与足量炭粉在高温下充分反应,测出生成Mg的质量
c.先加足量稀盐酸,再加足量NaOH溶液,充分反应,测出Mg(OH)2质量
Ⅱ.MgCl2是制备Mg2(OH)2CO3的原料,现用含碳酸镁84%的菱镁矿制备MgCl2,反应如下:MgCO3+Cl2+CO MgCl2+2CO2(设杂质不参加反应)。生产19吨MgCl2需要这样的菱镁矿多少吨?(写出计算过程)
MgCl2+2CO2(设杂质不参加反应)。生产19吨MgCl2需要这样的菱镁矿多少吨?(写出计算过程)
二氧化锰因在工业生产中应用广泛而备受关注,制备二氧化锰是一项有意义的工作,某研究性小组对此展开了系列研究。
Ⅰ.用高锰酸钾制备
资料一:(1)3K2MnO4+2H2SO4═2KMnO4+MnO2↓+2K2SO4+H2O
(2)K2MnO4易溶于水
实验室加热高锰酸钾制氧气,反应的化学方程式为 。其反应类型是 。将反应后的固体剩余物用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2,用稀硫酸而不用水浸取的原因是 。
Ⅱ.用硫酸锰制备:电解MnSO4溶液可制得活性MnO2,同时生成氢气和硫酸,该反应的化学方程式为 ,一段时间后溶液的pH将 (填“变大”、“变小”或“不变”)
Ⅲ.用废锂电池制备
资料二:2Al+2NaOH+2H2O═2NaAlO2+3H2↑
用废锂电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)制备纳米MnO2,并进行锂资源回收,流程如下:

请回答下列问题:
(1)“滤液”中溶质的主要成分是 (填化学式)。
(2)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、漏斗和 。
(3)MnO2与碳粉经下列三步反应制得纳米MnO2:
①2MnO2+C  2MnO+CO2↑
2MnO+CO2↑
②MnO+H2SO4═MnSO4+H2O
③3MnSO4+2KMnO4+2H2O═5MnO2↓+K2SO4+2H2SO4
上述涉及元素化合价变化的反应有 (填序号)。
IV.用碳酸锰制备
控制一定的温度,焙烧MnCO3制取MnO2的装置如下:

(1)实验中观察到澄清石灰水变浑浊,写出石英管中发生反应的化学方程式 。
(2)MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如图所示。图中B点对应固体成分的化学式为 (请写出计算过程)
试题篮
()