四氧化三铁是一种常用的磁性材料,由工业废料铁泥(含Fe、Fe2O3、FeO和杂质,杂质不参与反应)制取Fe3O4的一种流程如图:
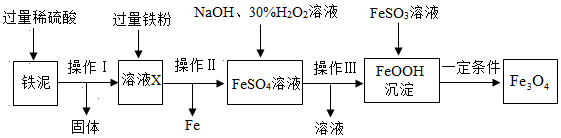
(1)操作Ⅱ的名称是 。
(2)Fe2O3与稀硫酸反应的化学方程式为 ,为使铁泥与稀硫酸充分反应,可采取的措施是 (答出一点即可)。
(3)向溶液X中加入过量铁粉的作用是 。
(4)FeOOH与FeSO3溶液在一定条件下反应生成Fe3O4和 (填化学式)。
老师要求用规定量的BaCl2溶液与适量的Na2SO4溶液制备BaSO4.完成操作I后,丁丁发现自己错把Na2CO3溶液当成Na2SO4溶液,而此时BaCl2溶液已完全消耗。老师启发他,可用生成物和其他试剂完成制备BaSO4的实验。整个实验流程如图所示:
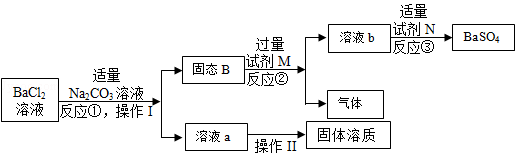
(1)反应②的化学方程式为 ,溶液b中的溶质有 。
(2)反应③的基本反应类型为 。
(3)操作Ⅱ的名称为 。
(4)从理论上讲,该实验过程最终得到的BaSO4质量与原方案得到的BaSO4质量是否相等? (填“是”或“否”)
氯化钙(CaCl2)可用作干燥剂、混凝土防冻剂等。实验室用工业大理石(含有少量Al2O3、Fe2O3、SiO2等杂质)制备氯化钙的主要流程如下:
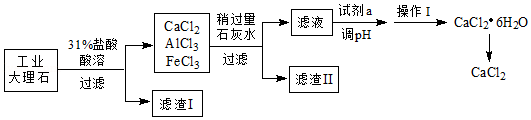
请回答下列问题:
(1)配制31%的稀盐酸730g,需要36.5%的浓盐酸 g。
(2)酸溶时碳酸钙参与反应的化学方程式为 。
(3)滤渣I的成分为 ,滤渣II中含有Al(OH)3和 。
(4)过滤使用到的玻璃仪器有 。操作I采用的方法是:蒸发浓缩、 、 、过滤。
(5)加入试剂a的目的是中和稍过量的石灰水,该反应的化学方程式为 。
在牙膏中常用轻质碳酸钙粉末作摩擦剂.小李在实验室以石灰石(杂质不反应也不溶于水)为原料制取轻质碳酸钙和氢氧化钠.

(1)操作②的名称是 .
(2)该流程中有两个反应,产物中均出现碳酸钙,这两个反应的化学方程式分别为 .
(3)为验证加入Na2CO3溶液后,溶液M中的溶质是否反应完全,可取上层清液加入 (填序号)进行检验.
A.碳酸钠溶液 B.铁粉 C.无色酚酞.
铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作补血剂。某硫酸厂产生的炉渣中除了有Fe2O3、FeO,还有一定量的SiO2.兴趣小组利用炉渣尝试制备FeCO3,其流程如图: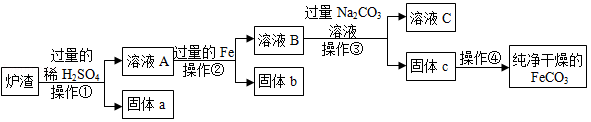
【已知:Fe+Fe2(SO4)3═3FeSO4;SiO2不溶于水,也不与稀硫酸反应】
(1)操作①的名称是 。
(2)溶液A中的溶质除H2SO4外,还存在 。
(3)上述流程中生成固体c的化学方程式 。
碲(Te)广泛用于彩色玻璃和陶瓷工艺。用某工业废渣(主要含有TeO2、少量Ag、Au)为原料制备碲的一种工艺流程如图:
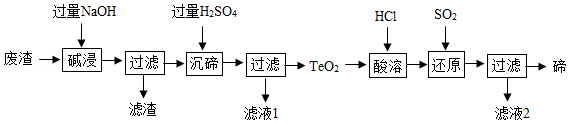
回答下列问题:
(1)类比CO2与NaOH的反应,写出“碱浸”时发生反应的化学方程式 。
(2)滤液1中的两种溶质是H2SO4和 (填化学式)。
(3)上述工艺流程中设计“废渣→…→TeO2”的目的是 。
(4)“酸溶”后,在TeCl4溶液中通入SO2,反应生成碲和初中化学中两种常见的酸,则该反应的化学方程式是 。
稀土元素被誉为“工业的维生素”,是不可再生资源,应用广泛。
①稀土元素与铝、钛等金属熔合,形成特种合金,其性能会有较大提高,强度更好,抗腐蚀性能更强。坦克、飞机、核潜艇等的制造都用到了特种合金。
②稀土元素在自然界中以化合物的形式存在。二氧化铈(CeO2)是稀土氧化物中用途极广的一种材料,因为具有较为独特的萤石晶体结构,使得其具有特殊的性能。主要用于玻璃、原子能、电子管等工业。
③中国的稀土储量最多时占世界的71.1%,目前占比在23%以下。中国并非世界上唯一拥有稀土的国家,却在过去几十年承担了世界稀土供应的角色,结果付出了破坏自身天然环境与消耗自身资源的代价。近几年,我国出台了一系列政策,采取了出口控制等措施,保护我国现有的稀土资源。
阅读以上材料,回答以下问题:
(Ⅰ)稀土元素铼与“太空金属”钛制成的钛铼合金,可用来制造核潜艇。请写出钛铼合金的优良性能(任写一点) 。
(Ⅱ)关于稀土资源,下列说法正确的是 (填序号)
A.稀土的开采与环境问题无关
B.稀土在材料工业方面发挥着重要作用,它是万能的
C.稀土元素化学性质稳定,在自然界中以单质形式存在
D.稀土不可再生,珍贵,保护稀土资源,是我们义不容辞的责任
(Ⅲ)某品牌平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。以此粉末为原料进行资源回收,其工艺流程如图:
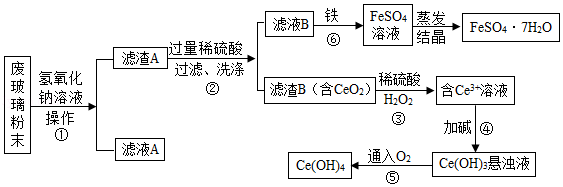
已知:2NaOH+SiO2=Na2SiO3+H2O,Na2SiO3溶于水。
(1)第①步操作的名称是 ;
(2)第②步加入过量稀硫酸的目的是 ;
(3)洗涤滤渣B的目的是为了除去 (填离子符号),提高产品的纯度;
(4)若第④步加的碱为NaOH,写出该反应的化学方程式 。
我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热到约800℃,得到黄铜(铜锌合金,外观似黄金),其流程如下:
请回答下列问题:
(1)赤铜矿中铜元素的化合价为 ;
(2)区分黄铜与黄金,可用酒精灯灼烧,若看到 ,则是黄铜;若表面无现象,则是黄金;
(3)气体A中除CO2外,还有一种气体是 (填化学式);
(4)加热时,发生反应的化学方程式有:①ZnCO3═ZnO+CO2↑
②C+2ZnO═2Zn+CO2↑ ③ ;(木炭粉与赤铜的反应)
已知化学反应中,物质所含元素化合价升高的反应叫氧化反应,物质所含元素化合价降低的反应叫做还原反应。在反应②中,ZnO发生 (填“氧化”或“还原”)反应;

波尔多液含氢氧化钙、氢氧化铜和硫酸钙等物质,是农业上常用的杀菌剂。一种生产波尔多液的工艺流程如图。
(1)“煅烧”的化学方程式为CaCO3 CaO+CO2↑,该反应属于基本反应类型中的 反应。
(2)“混合”时不能用铁制容器,原因是 。
(3)“混合”时需不断搅拌,目的是 。
(4)“混合”过程中硫酸铜和氢氧化钙反应生成氢氧化铜的化学方程式为 。
(5)“混合”后得到的波尔多液温度明显高于室温,原因是 。
(6)用 可以测定波尔多液酸碱度。

已知:向饱和食盐水中通入氨气得到饱和铵盐水,饱和铵盐水能与CO2发生反应:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl。某学习小组以饱和食盐水等为原料制备纯碱的主要流程如图:
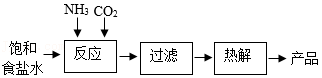
(1)常温时,饱和铵盐水的pH (填“=”或“>”)7。反应时,溶液中生成的NH4Cl中含有原子团的名称是 。
(2)过滤时,若经两次过滤滤液仍浑浊其原因可能是 (任写一条)。
(3)热解时,NaHCO3分解得到Na2CO3、CO2和H2O,该反应的化学方程式为 。
氯化亚铜CuCl是一种难溶于水和乙醇且在潮湿空气中易变质的物质,广泛应用于冶金、电镀、医药等行业、CuCl的制备流程如图:
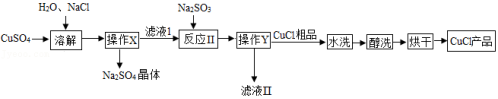
(1)"操作Y"名称是 。
(2)CuCl中铜元素的化合价为 。
(3)请配平"反应Ⅱ"的化学方程式: 。
(4)在"滤液Ⅱ"中可以循环利用的物质(水除外)是 。(填化学式)
(5)"醇洗"的目的是 ,防止后续过程中氯化亚铜变质。
无水氯化钙(CaCl 2)是重要的干燥剂,CaCl 2•6H 2O与冰的混合物是实验室常用的制冷剂,将CaCl 2•6H 2O加热可得CaCl 2.某工厂以石灰石为原料生产无水氯化钙的流程如图所示,原料石灰石中含有的杂质主要是MgCO 3、MgSO 4。

(1)过滤和蒸发均用到的玻璃仪器是 。
(2)石灰石溶解时,杂质MgCO 3发生反应的化学方程式为 ,该反应是 (填基本反应类型)
(3)加入BaCl 2溶液除去的杂质离子是 ,加入氢氧化钙溶液除杂的化学方程式为 。
(4)由CaCl 2•6H 2O得到CaCl 2是 变化(填"物理"或"化学")。
已知:NaOH溶液能与MgSO4溶液反应生成Na2SO4和难溶于水的Mg(OH)2.镁大多是从海水中提取。某小组从预先处理后的海水中提取镁的主要步骤如图:

(1)沉淀时,NaOH应过量的目的是 。
(2)过滤时,使用玻璃棒的作用是 。
(3)溶解时,稀盐酸与Mg(OH)2发生反应的化学方程式为 ,该反应的反应类型为 。
碳酸钾广泛应用于玻璃、纺织印染和肥皂生产等领域。制取碳酸钾的工艺流程示意图如图: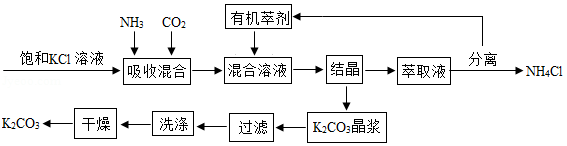
温度/℃ |
0 |
10 |
20 |
30 |
40 |
60 |
80 |
100 |
K2CO3的溶解度/g |
107.0 |
109.0 |
111.0 |
114.0 |
117.0 |
126.0 |
139.0 |
156.0 |
根据如图表信息,回答下列问题:
(1)生成碳酸钾的化学方程式为 。
(2)上述流程中可循环使用的物质是 ,NH4Cl在农业上可用作 。
(3)得到K2CO3晶浆的结晶方法是 。
(4)上述流程中洗涤K2CO3晶体应选用 (填序号)。
①NH4Cl溶液
②热水
③饱和K2CO3溶液
过氧化钙( CaO2)是用途广泛的优良供氧剂。以电石渣[主要成分为Ca(OH)2,含少量CaCO3为原料制备CaO2的一种工艺流程如图1:

[查阅资料]
Ⅰ.Ca(OH)2+2NH4Cl=CaCl2+2NH3•H2O
Ⅱ.CaCl2+2NH3•H2O+H2O2+6H2O=CaO2•8H2O↓+2NH4Cl
Ⅲ.CaO2•8H2O在水中不太稳定,会缓慢分解。
(1)“提取Ca(OH)2”时反应的基本类型是 ;Ca(OH)2的俗名为 ;“过滤1”所得滤渣的主要成分是 。
(2)在实验室进行过滤操作时,要遵循“一贴、二低、三靠”原则。其中“二低”指的是:滤纸边缘略低于漏斗口、 。生产过程中为了精确测定溶液的pH,常使用 (填仪器名称)。
(3)在其他条件不变的情况下,制备CaO2•8H2O的反应时间(t)对其产率(w)的影响如图2所示。
①平均反应速率最快的时间段为: (填字母)。
a.0~10min b.10~20min c.20~30min d.30~40min
②30min后,w开始下降的主要原因是 。
(4)为了测定加入的NH4Cl溶液中溶质的质量分数,取30.00g NH4Cl溶液于烧杯中,加入稍过量的AgNO3溶液,完全反应后过滤、洗涤、干燥、称量,得到14.35g 白色固体。通过计算确定该溶液中NH4Cl的质量分数(精确到0.1%) 。
试题篮
()