用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠。为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示。
(1)该纯碱样品中碳酸钠的质量分数。(精确到0.1%)
(2)所加入氯化钙溶液的溶质质量分数。
某化学兴趣小组为测定大理石中碳酸钙的含量,将过量的稀盐酸加入到20 g大理石中(其它成分不与盐酸反应),把产生的CO2气体用足量的NaOH溶液吸收,同时测量2分钟内NaOH溶液增加的质量,结果如下表所示:
| 时间/s |
O |
20 |
40 |
60 |
80 |
100 |
120 |
| 增加的质量/g |
O |
3.O |
5.O |
6.O |
6.6 |
6.6 |
6.6 |
试回答下列问题:
(1)请在右边的坐标纸上,以反应时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线;
(2)从表中可以看出,20 g大理石样品与盐酸反应生成的CO2质量最多是 g;
(3)计算大理石样品中碳酸钙的质量分数。
(6分) 某实验小组同学为测定一瓶久置过氧化氢溶液的溶质质量分数,进行了如下操作:取该溶液34克于烧杯中,加入1克二氧化锰完全反应后,称得烧杯内剩余物质的总质量为33.4克。试计算:
(1) 反应后生成氧气的质量;
(2)所取溶液中溶质的质量;
(3)该瓶过氧化氢溶液的溶质质量分数。
(丰台25)一定质量的稀硫酸和氢氧化钠溶液恰好完全反应,所得溶液中溶质质量分数为10%,则溶液中钠离子和水分子的个数比为
| A.1﹕71 | B.2﹕71 | C.1﹕79 | D.2﹕79 |
(东城21)在不同温度下,CO可将Fe2O3还原为Fe3O4、FeO或Fe,下列有关说法不正确的是
| A.生成固体的质量一定小于固体反应物的 |
| B.在实验室完成此实验,一定要对尾气进行处理 |
| C.一定量的Fe2O3还原为FeO时,消耗的CO最多 |
| D.生成的气体能使澄清石灰水变浑浊,该气体一定是CO2 |
(平谷25)肾病患者需要食用低钠盐的食品。目前,市场供应的低钠盐多为苹果酸钠盐(C4H5O5Na)。每日食用5g苹果酸钠盐,人体摄入的钠元素质量仅为等量食盐中钠元素质量的
| A.18.7% | B.26.7% | C.37.5% | D.43.1% |
(5分) 低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种。请回答:
①苹果酸钠盐的相对分子质量是 。
②苹果酸钠盐中氢和氧元素质量的最简质量比为 。 若实验室需制备2.2 L CO2,理论上需碳酸钙多少克?(写出解题过程)
(假设该状态下CO2的密度为2g/L)
(6分)为测定铜锌合金的组成,某化学小组的同学将200克稀硫酸分四次加入到40克合金中,得出如下数据和图像。请计算:a的数值为 。
合金中铜的质量分数为 。
计算实验所用稀硫酸的质量分数(写出计算过程)。
请回答下列有关“走进低碳”的问题:以下属于“不可回收垃圾”的是 (填序号):
①废作业本 ②矿泉水瓶 ③霉变面包 ④破旧铁桶下列符号“低碳”理念的最清洁燃料是 :
①煤 ②汽油 ③天然气 ④氢气碳酸钠溶液和稀盐酸可以反应生成二氧化碳。为测定某Na2CO3溶液的溶质质量分数,现称取10g碳酸钠溶液放在烧杯中并滴入稀盐酸,产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
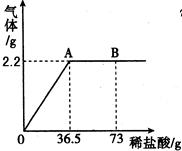
①读图可知,产生二氧化碳的质量为 ;
②该溶液中碳酸钠的质量为 ,质量分数为 ;
③A点时,烧杯内溶液中溶质的化学式 。
溶液的碱性强弱跟溶液中 的数量有关;一定体积的溶液中
的数量有关;一定体积的溶液中 数量越多,则溶液的碱性越强。同体积的10%的NaOH溶液与10%的KOH溶液(溶液密度相同)相比,碱性更强的是
数量越多,则溶液的碱性越强。同体积的10%的NaOH溶液与10%的KOH溶液(溶液密度相同)相比,碱性更强的是
| A.NaOH | B.KOH | C.一样强 | D.无法比较 |
6分)用右图微型仪器完成制取并检验CO2的实验只消耗了0.73g10%的盐酸。求:。
(1)产生CO2的质量是多少克?(结果保留三位小数)
(2)如果10%的盐酸密度为1.1g/mL,消耗盐酸的体积是
mL。(结果保留一位小数)
50g质量分数为36.5%的盐酸与30g大理石恰好完全反应(大理石中的杂质不参加反应)。
(1)计算反应生成二氧化碳气体的质量。
(2)计算该大理石中碳酸钙的质量分数。
氢氧化钠固体易吸收空气中的二氧化碳而变化。取4.65g已部分变质的氢氧化钠固体跟36.5g 10%的盐酸恰好完全反应后,将溶液蒸干,所得固体的质量是
| A.11.7g | B.5.85g | C.4.65g | D.8.3g |
现有一瓶久置的标有质量分数为10%的NaOH溶液样品,为探究其变质(NaOH易和空气中的CO2反应生成Na2CO3)的相关问题,利用∪形管设计如下图所示的装置进行实验。
(1)如图46-1所示,若此溶液变质,分别在∪形管的两端滴入HCl溶液和澄清的石灰水时,观察到的现象:a端 ,b端 。
(2)如图46-2所示,取此NaOH样品溶液20g于∪形管中,并在其中加入适量的酚酞试液,通过分液漏斗向∪形管中滴入HCl溶液,当滴入20gHCl溶液时,恰好反应完全。
①滴入稀盐酸过程中,∪形管中的溶液颜色变化为 ;
②恰好完全反应时,生成气体0.22g,试通过计算得出20gNaOH样品溶液中所含Na2CO3的质量。
小明家购买了一瓶白醋,标签上注明醋酸的质量分数≥5%。小明想:这瓶白醋中醋酸的含量是否与标签的标注相符?请你用有关酸碱的知识,定量测定白醋中醋酸的含量。
《实验原理》
⑴用已知浓度的氢氧化钠溶液和醋酸反应,反应的化学方程式为:
CH3COOH + NaOH = CH3COONa + H2O
⑵在混合溶液中,当醋酸和氢氧化钠完全中和时,再增加1滴氢氧化钠溶液,溶液就呈碱性,而1滴氢氧化钠溶液约为0.05 ml,对测定结果的影响很小,可忽略不计。
《实验步骤》
⑴用 取12.0 mL白醋(密度近似为1.0g/ ml),倒入烧杯中,加入20 ml蒸馏水稀释,再滴入几滴酚酞试液。
⑵量取45.0 ml溶质质量分数为1.0%的氢氧化钠溶液(密度近似为1.0 g/ ml),用胶头滴管取该氢氧化钠溶液,逐滴地滴加到稀释后的白醋中,同时不断地搅拌烧杯中的溶液。滴至恰好完全反应,剩余氢氧化钠溶液5.0 ml。
《交流反思》⑴在实验步骤①中,加适量水稀释白醋,对实验结果有无影响?为什么?
⑵在实验步骤②中,小明如何确定醋酸和氢氧化钠已完全中和?
《数据处理》根据实验数据,通过计算判断白醋中醋酸的含量是否与标签的标注相符?
试题篮
()