用一定量的NH4NO3和KH2PO4的固体混合物可以配制无土栽培营养液,已知固体混合物中氮元素的质量分数为28%,则固体混合物中KH2PO4的质量分数为
| A.20% | B.25% | C.80% | D.85% |
将一定质量的高锰酸钾放在试管内加热一段时间后,测得反应后生成氧气的质量小于原高锰酸钾质量的10%,则反应后的固体物质与原高锰酸钾的质量比可能是
| A.71︰75 | B.71︰79 | C.80︰79 | D.81︰79 |
将适量的下列物质,分别投入等质量、等溶质质量分数的稀盐酸中,恰好完全反应后,产生的气体全部逸出,所得溶液中的MgCl2的质量分数最大的是
| A.Mg | B.MgO | C.Mg(OH)2 | D.MgCO3 |
右图是某乳业公司纯牛奶包装标签的部分文字。请仔细阅读后回答下列问题:
| 纯牛奶 保持期:8个月 净含量:250mL/盒 营养成分:(每100mL) 钙≥0.1lg 脂肪≥3.3g 蛋白质≥2.9g |
(1)包装标签上脂肪≥3.3g,是指100mL牛奶中至少含有3.3g的脂肪。那么一盒牛奶中至少含有 g 脂肪(保留到0.01g)。
(2)人体中的钙主要以羟基磷酸钙晶体[Ca10(PO4)6(OH)2]形式存在。羟基磷酸钙的相对分子质量为 ;羟基磷酸钙中钙元素的质量分数是 (保留到0.1%)。
(3)人体中含量最高的金属元素 (填“是”或“不是”)钙。
(4)若人体每天至少需要0.6g钙,且这些钙有90%来自牛奶,则一个人每天至少要喝 盒牛奶,书写另一可用于补钙的食物 。
钠元素在人体内可起到调节体液平衡,维持肌肉正常兴奋和细胞的通透性等作用。假设钠元素全部来源于食盐(NaCl)
(1) 某病人因为食盐的摄入量不够,需静脉输入一定量的生理盐水(NaCl的质量分数为0.9%,密度约为1g/ml)。医生给她确定每天应补充NaCl约2.7g,问每天需输入生理盐水多少毫升?
(2) 某卫生部门对市场上一批生理盐水进行质量分析,取这种生理盐水250ml,逐滴加入某未知浓度的AgNO3溶液200g,生成沉淀的质量与加入AgNO3溶液的质量关系如图。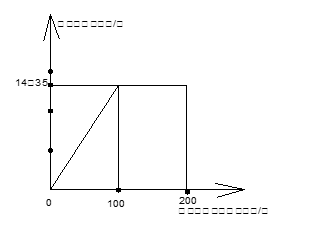
试通过计算判断这批生理盐水是否符合质量分数为0.9%的医用标准,及所用AgNO3溶液的质量分数。
工业上以黄铁矿(主要成分FeS2,杂质不含硫元素)为原料生产硫酸。其反应原理为:①FeS2与O2高温下反应生成SO2;②SO2在催化剂作用下与O2反应生成SO3;③SO3与H2O反应生成H2SO4。试回答以下问题:
⑴生产中的尾气未经处理,排放到空气中会引起的环境问题是 。
⑵FeS2中硫元素的质量分数为 。
⑶若1.00 t SO2与O2的混合气体中,含SO2 0.40 t。在一定条件下反应,有80%的SO2发生转化,则反应后SO3的质量是 ,反应后混合气体中SO3的质量分数是 。
⑷若上述SO3与H2O完全反应,可生产98%浓硫酸多少吨?(计算过程写在答题卡上)
小强在公共场所围墙上看到一则化肥广告(如图),他通过计算判断出该广告是虚假广告,并向有关部门反映。
(1)请计算硝酸铵中各元素的质量比。(请写出详细的计算过程)
(2)已知该产品中的杂质不含氮元素,请你尝试写出小强的计算过程和判断依据。(请写出详细的计算过程)
(3)技术监督局对该产品进行取样分析,发现氮元素的质量分数仅为28%。请计算该产品中硝酸铵的质量分数。(请写出详细的计算过程)
为测定某石灰石样品中碳酸钙的含量,取样品10g于烧杯中,再向其中加入稀盐酸50g,恰好完全反应(杂质不反应),反应后烧杯中物质总质量为56.7g。
(CaCO3+2HCl=CaCl2+CO2↑+H2O)
(1)生成CO2的质量为_______ g。
(2)求石灰石样品中碳酸钙的质量分数。
“凯式定氮法”是通过测奶品中含氮量(氮元素的质量分数)来折算奶品中蛋白质含量的一种方法。为了提高氮的含量,不法分子将三聚氰胺(化学是为C3H6N6)添加进奶品中,冒充蛋白质,使许多婴幼儿长期服用后产生结石,严重影响婴幼儿的健康。不法分子如果向1000g牛奶中添加2.52g三聚氰胺,能够冒充蛋白质的质量为(已知蛋白质中所含氮元素的质量分数约为16%)
| A.2.52g | B.4. 44g | C.10.5g | D.12.32g |
A、B、C三种物质各20 g,它们化合时只能生成40 g的新物质D。再增加5 g B,反应停止时只有A剩余。下列说法正确的是
A.反应中A和C的质量比是5∶4
B.第一次反应后,A剩余质量为4 g
C.反应中D和C的质量比是5∶2
D.第二次反应后,D的质量为65 g
碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂。相关信息如下图所示。同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究。
[提出问题]实验室中久置的碱石灰样品的成分是什么?
[进行猜想] 久置的碱石灰样品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分。用化学方程式表示样品中含有Ca(OH)2或Na2CO3可能含有的原因 (写一个)
[探究过程]
试回答下列问题:
(1)操作①的名称是 ,溶液C中一定含 离子。
(2)溶液A中加入CaCl2溶液后产生固体,说明样品中一定含有 ,反应的方程式为 。
(3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是 。
[实验结论]
依据上述实验操作过程及现象,综合对滤液和固体成分的探究,下列对样品成分的分析正确的是 (填序号)
①样品中一定含NaOH ②样品中一定含Na2CO3 ③样品中含NaOH、CaO中的一种或两种
[拓展延伸]
为测定实验室中一瓶变质的烧碱中NaOH的含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g。请分析计算:
(1)反应产生的CO2的质量为 g。
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?(写出计算过程)
(3)用同浓度的硫酸,分别与未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等。从钠元素质量守恒的角度解释其原因是: 。
碳酸钠和碳酸氢钠的固体混合物充分加热至恒重,其质量变化如下图所示。另取相同质量的该混合物溶于水得到106.6 g溶液,向该溶液中加入100 g 7.3% 的稀盐酸,恰好完全反应。(已知:2NaHCO3 Na2CO3+CO2↑+H2O,碳酸钠受热不易分解。)
计算:(1)混合物与盐酸反应生成二氧化碳的质量。(2)所得溶液中溶质的质量分数。
将一定质量的镁、铝合金(不含其他物质)与足量的稀硫酸充分反应后,生成0.2g氢气,原混合物的质量不可能是
| A.1.2g | B. 2.0g | C.2.2g | D.1.9g |
试题篮
()