为了测定某赤铁矿中氧化铁的质量分数,现取赤铁矿样品,与质量分数为19.6%的稀硫酸在烧杯(烧杯质量为50g)中恰好完全反应(假设赤铁矿样品中杂质不与稀硫酸反应也不溶于水).有关实验数据如下表:
| |
反应前 |
反应后 |
|
| 实验 数据 |
烧杯和稀硫酸的质量 |
赤铁矿样品的质量 |
烧杯和混合物的质量 |
| 200g |
20g |
220g |
(1)配制上述质量分数为19.6%的稀硫酸,需要质量分数为98%的浓硫酸的质量是 ;
(2)发生反应的化学方程式为 ;
(3)利用已知条件求解氧化铁质量(X)的比例式为 ;
(4)向反应后所得溶液中加入34g水,则最终溶液中溶质的质量分数是 ;
(5)利用150t该赤铁矿可制得含杂质的生铁的质量是 .
已知草酸钙(CaC2O4)在400℃--500℃时发生反应的化学方程式:
CaC2O4="=" CaCO3+CO↑,当温度达到800℃以上,该反应生成的固体开始分解。
(1)若反应控制在400℃--500℃范围内:填写下表
| 参加反应的草酸钙固体的质量分数 |
0 |
60% |
100% |
| 剩余固体中m(O)/m(Ca) |
|
|
|
(2)若取6.4g草酸钙在800℃以上的温度下加热,则
①剩余固体质量的最小值是
②当剩余固体质量为3.9g时,剩余固体中氧元素与钙元素的质量比= (用最简分数表示)
硅钢是制变压器、充电器的核心材料,其主要成分是Fe和Si.某同学用硅钢样品进行如下实验:取6.60g硅钢样品,将60.00g稀硫酸分6次加入样品中(其中稀硫酸与硅及其它杂质不反应).实验测得相关数据如表:

(1)根据表中数据判断,稀硫酸加入到第 次,铁恰好反应完全.
(2)表中W= g
(3)计算该稀硫酸溶质的质量分数(写出过程)
菱铁矿(主要成分是
)是炼铁的原料。现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如下图所示。
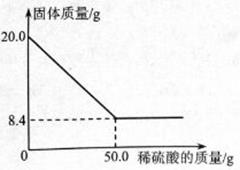
已知:①
②菱铁矿中杂质不参加反应,且难溶于水。
请计算:
(1)20.0g菱铁矿中
的质量为g。
(2)列式计算所用稀硫酸的溶质质量分数(结果准确到0。1%)
小强取回了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的方法,取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下列(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)请计算
| 序号 |
加入稀盐酸质量(g) |
剩余固体质量(g) |
| 1 |
10 |
5.5 |
| 2 |
10 |
m |
| 3 |
10 |
1.0 |
| 4 |
10 |
1.0 |
(1)8g的石灰石样品中含有杂质______克
(2)上表中m的数值=__________
(3)8g石灰石样品完全反应生成二氧化碳多少克?
某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应,实验数据如下表:
| |
甲 |
乙 |
丙 |
| 烧杯+稀硫酸 |
200g |
150g |
150g |
| 加入的铁样品 |
9g |
9g |
14g |
| 充分反应后,烧杯+剩余物 |
208.7g |
158.7g |
163.7g |
请你认真分析数据,回答下列问题:
(1)哪位同学所取的稀硫酸与铁样品恰好完全反应;
(2)计算样品中铁的质量分数;
(3)计算恰恰好完全反应后所得溶液中溶质的质量分数。(烧杯的质量为25.4g;计算结果精确到1%)
测定铁制品中铁的质量分数
铁是常用的金属材料,兴趣小组的同学对某铁制品中的质量分数进行测定.称取3
铁屑,缓慢加入一定溶质质量分数的硫酸溶液,直到过量(假设除铁以外的物质都不与硫酸反应),实验数据如图所示.

请计算:
(1)该铁制品中的铁的质量分数.(最终结果保留到0.1%)
(2)所用硫酸溶液的溶质质量分数.(要求有计算的过程)
有一含有纯碱的食盐样品,为了测定其中碳酸钠的含量,某同学称取30g的样品放入烧杯中,向烧杯中加入100g足量的稀盐酸,充分反应后气体全部逸出,烧杯中剩余物的总质量为123.4g(假设产生的气体全部逸出。)
(1)反应中生成的气体的质量是 g;
(2)样品中碳酸钠的质量分数是多少?
过氧化氢不稳定会自然分解,久置的过氧化氢溶液,其过氧化氢的质量分数会变小。某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中过氧化氢的质量分数,进行实验。测得相关数据如图所示:

(1)根据质量守恒定律,反应生成氧气的质量为 。
(2)计算该过氧化氢溶液中过氧化氢的质量分数。(写出计算过程)
现将10g铜锌(Cu﹣Zn)合金放入到一定质量的稀硫酸中恰好完全反应,过滤得到100g溶质质量分数为16.1%的溶液.据此请完成下列问题:
(1)生产氢气 g;
(2)稀硫酸中H2SO4的质量是 g;
(3)合金中铜的质量分数是多少?
新冠肺炎疫情期间,可用体积分数为75%的乙醇(C2H5OH)消毒液进行手和其他皮肤的消毒。如图为某品牌乙醇消毒液的标签。(纯乙醇的密度约为0.8g/mL,水的密度约为1.0g/mL)。
请回答下列问题:
(1)H2O的相对分子质量为 ,H2O分子中H原子与O原子的个数比为 。
(2)乙醇由 元素组成,配制乙醇消毒液需要乙醇和水的体积比为 。
(3)乙醇消毒液中乙醇的质量分数约为多少?(要求写出计算过程,结果精确到0.1%)

实验室用40克含碳酸钙75%的石灰石样品与足量的稀盐酸混合制取二氧化碳(化学反应方程式为:CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑)。
求:
(l)40克石灰石样品中含碳酸钙 克;
(2)充分反应后,理论上可制得二氧化碳多少克?(要求:结合化学方程式计算,并写出计算过程)
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙.他们为了测定水垢中碳酸钙的含量,将足量盐酸加入到12.5g水垢中,产生CO2气体的情况如图所示.
从图中可以看出,12.5g水垢与足量盐酸反应后生成的CO2最多是 g.
水垢中碳酸钙的质量分数是多少?

为测定某石灰石样品中CaCO3的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应,也不溶于水)有关实验数据如下表:
| 实验数据 |
反应前 |
反应后 |
| 烧杯和稀盐酸的质量/g |
石灰石样品的质量/g |
烧杯及剩余物的质量/g |
| 150 |
12.5 |
158.1 |
(1)反应中生成二氧化碳的质量 。
(2)求该石灰石中CaCO3的质量分数。
永州市某中学的初三化学课堂上,刘老师布置了一道计算题,题目如下:取100g溶质质量分数为8%的氢氧化钠溶液于烧杯中,向其中加入100g19.6%的稀硫酸,充分反应后,求所得溶液中硫酸钠的质量分数.
检查作业发现,班上出现了下表所示的两种情形:
| 结果编号 |
① |
② |
| 计算结果 |
14.2% |
7.1% |
请你分析并回答:
(1)你赞同的计算结果是 (填结果编号)。
(2)请写出该题正确计算的详细过程。
试题篮
()