某硝酸铵样品,经测定含氮量为25%,已知该样品中只含有一种杂质,则该样品可能混有下列物质中的
| A.NH4 Cl | B.(NH4)2SO4 | C.CO(NH2)2 | D.NH4HCO3 |
已知某种NH4NO3样品中混有不含氮元素的杂质,测得该NH4NO3样品中含氮的质量分数为24.5%,则样品中NH4NO3的质量分数为
| A.24.5% | B.49% | C.70% | D.80% |
氮化铝( )被广泛应用于集成电路生产领域。在氮气( )流中由氧化铝与焦炭在高温条件下制得氮化铝: 。若有14 的氮气参加反应,可生成氮化铝的质量为多少?
现有10.6g碳酸钠和8.4g碳酸氢钠,分别与过量盐酸反应,其中()
| A. | 碳酸钠消耗的氯化氢多 | B. | 碳酸氢钠生成的二氧化碳多 |
| C. | 碳酸氢钠消耗的氯化氢多 | D. | 碳酸氢钠生成的二氧化碳多 |
将一定质量的铁和氧化铜的混合物粉末放入足量稀盐酸中,充分反应后产生气体0.4g,并得到残留固体6.4g。则原混合物粉末的质量是()
| A. | 8.0g | B. | 11.2g | C. | 16.0g | D. | 19.2g |
取一定质量的CaCO3高温加热一段时间后,冷却,测得剩余固体的质量为8.0 g,剩余固体中钙元素的质量分数为50.0%。下列判断正确的是
| A.生成2.0 g CO2气体 | B.原来CaCO3的质量为14.3 g |
| C.生成了5.6 g CaO | D.剩余CaCO3的质量为3.0 g |
现向12g Mg0和Cu0的混合物中加入稀硫酸至恰好完全溶解,再向所得溶液中加入NaOH溶液至恰好沉淀完全,生成Mg(OH)2和Cu(OH)2沉淀的总质量为15.6g, 则参加反应的NaOH的质量为
| A.3.6g | B.4.0g | C.8.0g | D.16.0g |
有一含CaCO3与CaO的混合物,取该混合物16g,进行充分高温煅烧后,将剩余固体投入200g溶质质量分数为7.3%的稀盐酸中,恰好完全反应,则原混合物中钙元素的质量分数为
| A.30% | B.40% | C.50% | D.60% |
将13.7g Na2CO3和NaHCO3的固体混合物,加热至固体质量不再减少,然后向此固体中加入一定量的氯化钙溶液,恰好完全反应后过滤,得到117g溶质质量分数为10%的不饱和溶液,则原固体混合物中钠元素的质量为
| A.2.3g | B.4.6g | C.6.9g | D.9.2g |
将Cu、CuO、Cu(OH)2的混合物12g加入到稀硫酸中,恰好完全反应后,过滤,得到含硫元素的3.2%的溶液50g和滤渣4g,则原混合物中Cu元素的质量分数为
| A.70% | B.60% | C.40% | D.33% |
某固体混合物由Mg和MgO组成,取该混合物6.4g与一定量稀硫酸恰好完全反应(反应后溶液中无晶体析出),所得溶液中溶质的质量为24g,则原混合物中氧元素的质量为
| A.4.8g | B.3.2g | C.2.56g | D.1.6g |
在10g碳酸钙固体高温煅烧一段时间,冷却后投入足量稀盐酸中完全反应。有关结论错误的是()
| A. | 共生成0.1mol氯化钙 | B. | 燃烧越充分则消耗的盐酸量越少 |
| C. | 共生成0.1mol二氧化碳 | D. | 燃烧后固体中氧元素的质量分数减小 |
某物质的充分燃烧产物是CO2和H2O,为了确定该物质的元素组成,某小组设计了如下图所示实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略)。称取0.84g待测物完全燃烧后,称得D装置增重1.08 g,E装置增重2.64 g。则下列推断正确的是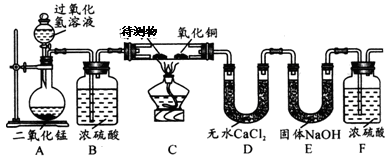
A.该物质一定含有C、H元素,没有氧元素
B.该物质一定含有C、H、O元素
C.用充有空气的储气球代替装置A、B更有利于实验的进行
D.氧化铜的有无对实验结果没有影响
现有一定质量的甲烷不完全燃烧,生成一氧化碳、二氧化碳和水蒸气的混合气体75g,经测定混合气体中碳元素的质量分数为16%,则参加反应的氧气的质量是
| A.48g | B.56g | C.59g | D.64g |
Fe2O3、CuO的固体混合粉末a g,高温下用足量氢气还原,得到金属混合物2.40 g,将生成的水用足量的浓硫酸吸收后,浓硫酸增重0.9克,则a的值为
| A.3.20 | B.3.30 | C.4.00 | D.4.20 |
试题篮
()