将一定质量的高锰酸钾放在试管内加热一段时间后,测得反应后生成氧气的质量小于原高锰酸钾质量的10%,则反应后的固体物质与原高锰酸钾的质量比可能是
| A.71︰75 | B.71︰79 | C.80︰79 | D.81︰79 |
钠元素在人体内可起到调节体液平衡,维持肌肉正常兴奋和细胞的通透性等作用。假设钠元素全部来源于食盐(NaCl)
(1) 某病人因为食盐的摄入量不够,需静脉输入一定量的生理盐水(NaCl的质量分数为0.9%,密度约为1g/ml)。医生给她确定每天应补充NaCl约2.7g,问每天需输入生理盐水多少毫升?
(2) 某卫生部门对市场上一批生理盐水进行质量分析,取这种生理盐水250ml,逐滴加入某未知浓度的AgNO3溶液200g,生成沉淀的质量与加入AgNO3溶液的质量关系如图。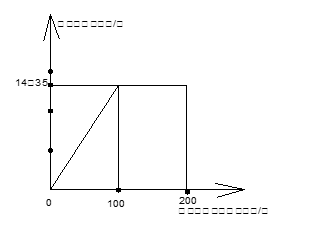
试通过计算判断这批生理盐水是否符合质量分数为0.9%的医用标准,及所用AgNO3溶液的质量分数。
下图是实验室常用的装置,请回答下列问题:
⑴写出仪器①的名称 。收集某气体能采用E装置,由此推测该气体具有的
性质是 。
⑵实验室制备并收集氧气的装置组合是 (填装置序号),反应的化学方程式为 ;若用F装置收集该气体,则气体应从 端进入(填“a”或“b”);装置A、B都可以用来制取二氧化碳,比较这两个装置,指出A装置的一个突出优点是 。
⑶实验室制得的CO2气体中常含有HCl和水蒸气,为了得到纯净、干燥的CO2气体,除杂装置的导管气流方向连接顺序是 (填选项字母编号)。
A.c→d→e→f B.d→c→e→f C.e→f→c→d D.f→e→d→c
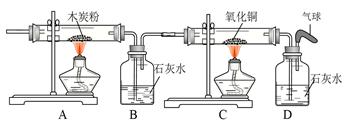
(4)将氧气通入如下图所示的装置,实验中观察到B中澄清石灰水变浑浊,C中黑色固
体变为红色,则进入装置B的气体一定含有 ,B处发生反应的化学方程式是 。
⑸实验室制取氧气时常用二氧化锰作催化剂。某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计的实验方案是:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定。
①如下图所示是用干燥纯净的氧气与样品反应来测定二氧化锰质量分数的装置,仪器②中装有碱石灰(氧化钙和氢氧化钠的混合物),其作用是 。
②为验证装置①已将CO2吸收完全,可在装置①与②之间加入
装置进行证明。
③现称取5.0 g二氧化锰样品进行实验,装置①反应前后的质量差为1.1g,则样品中二氧化锰的质量分数为多少?(写出计算过程)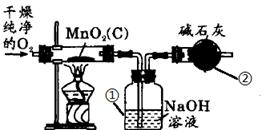
请回答下列有关“走进低碳”的问题:以下属于“不可回收垃圾”的是 (填序号):
①废作业本 ②矿泉水瓶 ③霉变面包 ④破旧铁桶下列符号“低碳”理念的最清洁燃料是 :
①煤 ②汽油 ③天然气 ④氢气碳酸钠溶液和稀盐酸可以反应生成二氧化碳。为测定某Na2CO3溶液的溶质质量分数,现称取10g碳酸钠溶液放在烧杯中并滴入稀盐酸,产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
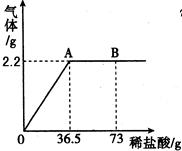
①读图可知,产生二氧化碳的质量为 ;
②该溶液中碳酸钠的质量为 ,质量分数为 ;
③A点时,烧杯内溶液中溶质的化学式 。
向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g。回答下列问题: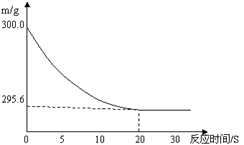
(1)当固体混合物与稀盐酸恰好完全反应时,所需时间约为 S。
(2)完全反应后,产生二氧化碳气体质量 g。
(3)反应后,得到室温下的不饱和溶液。所得溶液中溶质的质量分数为多少?
不同年龄段的人群每天钙的适宜摄入量不同,哺乳期妇女每日推荐摄入量为1200mg,右图为某保健品说明书的一部分,请回答:
(1)维生素D3的化学式为C27H44O ,则维生素D3中C、H、O三种元素的质量比是 。
(2)假设某哺乳期妇女每天服用“钙尔奇”1片,则能补充 mg的钙(“钙尔奇” 中除碳酸钙外其他成分不含钙元素)。
空气对于我们人类是一种重要的物质,我们每时每刻都离不开它。
(1)空气中含量最多的气体的相对分子质量是__________
(2)二氧化碳在空气中的正常体积含量是0.03%,当空气中二氧化碳的含量增加至0.15%时,会使人感到头晕,此时应换气或开窗通风。二氧化碳中氧元素的质量分数是______;
(3)有一间60m2的教室,其高度为3m已知空气的密度是1.293 g/L,氧气的密度是1.429g/L。阅读小资料,计算该教室中氧气的质量是多少克?
(只写出计算式,不计算结果)氧气的质量= _____________________________。
不少同学都被蚊虫叮咬过,感觉又痛又痒。从化学课上得知:蚊虫叮咬时能在皮肤内分泌出蚁酸刺激皮肤。查阅资料:蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH,通常是一种无色易挥发的液体,它在浓硫酸存在时加热发生如下反应:HCOOH浓硫酸CO↑+H2O。某化学兴趣小组同学决定使用下图仪器或装置利用甲酸制取CO,并进行CO还原Fe2O3(Fe2O3样品中杂质不参加反应)的探究实验。
请回答下列问题: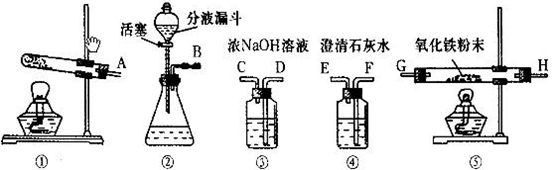
(1)用甲酸滴入浓硫酸的方法制取CO,应选用的发生装置是 (填代号,下同);要除去CO中含有的少量甲酸蒸汽,最好选用上图中的 进行洗气;检验CO还原Fe2O3的气体产物应选用 装置,需检验的气体应从 管口进入。
(2)写出CO还原Fe2O3的化学方程式______________________________。
(3)从开始加热到实验结束,Fe2O3粉末的颜色是如何变化的?_________________。
(4)CO有毒,从环保角度看,如何处理该实验的尾气?_________________。
(5)【拓展延伸】①当你被蚊虫叮咬后,在叮咬处涂抹一些物质可减轻痛痒。下列物质中,你不会选择的物质是________。
| A.氨水 | B.食醋 | C.肥皂水 | D.苏打水 |
②向某溶液中加入蚁酸有气泡产生,该气体能使澄清石灰水变浑浊,则该溶液中溶质的化学式可能是______________________________(只写一种)。
(6)利用以上装置可以测定Fe2O3样品中Fe2O3的质量分数。测定方法是:取10.0g Fe2O3样品做实验,先称量样品和玻璃管的总质量为60.0g,待样品完全反应并冷却后,在称量玻璃管和剩余固体的总质量为57.6g。求该样品中Fe2O3的质量分数是多少?
(10哈尔滨37).某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数。取20g石灰石样品(假设杂质既不溶于水,也不与其他物质反应),向其中加入100g一定溶质质量分数的稀盐酸,恰好完全反应,称得固液混合物的质量为113.4g。请回答下列问题:
(1)写出反应的化学方程式 ;
(2)列出求解该样品中参加反应的碳酸钙质量(x)的比例式 ;
(3)该样品中碳酸钙的质量分数为 ;
(4)向反应后的固液混合物中加入113.6g水,充分搅拌后过滤,得到只含一种溶质的不饱和溶液,则所得不饱和溶液中溶质的质量分数为 ;
(5)欲配制150g上述实验所用的稀盐酸,需要36.5%的浓盐酸质量为 。
【10新疆20】.作物的无土栽培可以显著提高产品的产量和质量。某茄子的无土栽培营养液中含有7%的KNO3。
(1)KNO3属于 (选填“复合肥料”、“氮肥”“钾肥”或“磷肥”)。
(2)要配制150kg该营养液,需要KNO3的质量 kg。
早在西汉时期,我国就用铁与硫酸铜溶液反应制取铜,称为“湿法炼铜”。求:
⑴请写出“湿法炼铜”的化学方程式: 。
⑵若用该方法制得铜32g,反应的铁的质量 g,若同时消耗了500g硫酸铜溶液,则该硫酸铜溶液中硫酸铜的质量分数为 %。
小江同学为了寻找含碳酸钙质量分数超过80%的石灰石,对样品进行如下定量实验:
| 实验步骤 |
Ⅰ.将过量稀盐酸加入烧杯中并称重 |
Ⅱ.称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 |
Ⅲ.待反应完全后,称重 |
| 实验图示 |
 |
||
| 实验数据 |
烧杯和稀盐酸的质量为100.0g |
石灰石样品的质量为15.0g |
烧杯和其中混合物的质量为110.6g |
试通过分析计算(结果保留一位小数)
(1)该实验中生成的二氧化碳的质量是 g,物质的量为 mol。
(2)试通过计算推断该石灰石样品的纯度是否符合要求(石灰石样品中的杂质不与盐酸反应)?(写出解题过程)
有一瓶标签破损的稀硫酸,为测定其溶质 ,取出20g溶液,加入足量的锌粒。充分反应后,产生氢气0.02g。
算20g溶液中H2SO4的物质的量(根据化学方程式列式计算)。
②计算并在新标签的横线上填写该溶液的溶质质量分数。
已知碳酸氢钠在
左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解.现有某工厂生产出的一批碳酸氢钠中混有少量的碳酸钠,为了测定产品中碳酸氢钠的质量分数,具体的检验步骤如下:
①取一只洁净的坩埚,称其质量为
;再向其中加入样品。称得总质量为
;
②加热该盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为
。
(1)写出碳酸氢钠受热分解的化学方程式。
(2)用(填仪器名称)将加热后的坩埚放到中(填序号)冷却。
| A. |
|
B. |
|
C. |
|
D. |
|
(3)根据题意,用
、
、
的代数式表示样品中碳酸氢钠的质量分数为。
(4)步骤①、③和④都需要用到精度为
的托盘天平称量,若本题中
的值超过
,假设样品中碳酸氢钠的质量分数为
,则至少需称样品多少克?
某中学课外活动小组在实验室模拟我国化工专家侯德榜先生发明的"联合制碱法"(即"侯氏制碱法"),其原理是向氨化的饱和氯化钠溶液通入足量的二氧化碳,使溶解度较小的碳酸氢钠从溶液中析出,其反应的化学方程式为:
。该方法不但可以制得纯碱(将
进一步处理即可得到纯碱),还得到优质氮肥氯化氨。
试通过计算回答下列问题:
⑴氯化氨中氮元素的质量分数为(计算结果保留0.1%)
⑵实验中得到碳酸氢钠8.4
,求参加反应的氨气质量为多少?
⑶课外活动小组为了这次模拟实验,准备了8.8
二氧化碳,制取这些二氧化碳需要消耗质量分数为10%的稀盐酸的质量为多少?
试题篮
()