现有部分被氧化的铜粉固体混合物,为研究铜粉的组成情况,取4g混合物,先加热完全氧化后,再加入60g9.8%的稀硫酸恰好完全反应,则固体混合物中铜单质的质量分数为( )
| A. |
80% |
B. |
64% |
C. |
16% |
D. |
96% |
下列过程中不发生化学变化的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
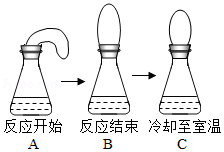
小柯做了一个趣味实验:他先将鸡蛋壳碾碎装入气球,再把气球套在盛有白醋的锥形瓶瓶口,然后把气球中的蛋壳加入锥形瓶中(装置的气密性良好),实验过程如图。下列对该实验的分析正确的是( )
| A. |
不能验证质量守恒定律,因为气球受到浮力 |
| B. |
冷却至室温时,瓶内气体分子间空隙变大 |
| C. |
反应没有气体生成 |
| D. |
反应没有热量放出 |
如图是某化学反应的微观示意图。下列说法中错误的是( )

| A. |
甲是最简单的有机物 |
| B. |
反应前后原子种类没有发生改变 |
| C. |
反应生成的丙和丁的分子个数比为1:2 |
| D. |
一个甲分子是由两个氢分子和一个碳原子构成 |
"丹砂烧之成水银"中的"丹砂"指的是硫化汞。该反应的微观示意图如下,有关说法正确的是( )
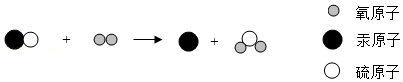
| A. |
"●"代表非金属单质汞 |
| B. |
此反应遵循质量守恒定律 |
| C. |
反应前后原子的种类发生改变 |
| D. |
反应前后各元素的化合价都不变 |
洁厕灵是常用的陶瓷清洗液,小彭同学对某品牌洁厕灵的有效成分及其含量进行研究。
(1)查阅资料得知:洁厕灵有效成分是HCl.HCl的含量可通过已知溶质质量分数的NaHCO 3溶液来测定,其它成分均不参与反应。请完成HCl与NaHCO 3反应的化学方程式:HCl+NaHCO 3=NaCl+ +CO 2↑。
(2)配制一定溶质质量分数的NaHCO 3溶液,需要用到的玻璃仪器有烧杯、滴管和 。
(3)向一锥形瓶中加入100克该品牌的洁厕灵,再逐次加入相同质量分数的 NaHCO 3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
| |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
| 加入NaHCO 3溶液的质量/g |
40 |
40 |
40 |
40 |
40 |
| 反应后溶液的总质量/g |
138.9 |
177.8 |
216.7 |
255.6 |
295.6 |
试分析计算下列问题:
①第一次实验时,所加 NaHCO 3溶液中溶质质量是多少克?
②该品牌洁厕灵中HCl的质量分数是多少?
谷氨酸钠(化学式为C 5H 8NO 4Na)是味精的主要成分。下列关于谷氨酸钠的说法错误的是( )
| A. |
是一种有机物 |
B. |
加热会产生含硫物质 |
| C. |
由五种元素组成 |
D. |
碳、氢原子个数之比为5:8 |
水体中氮元素含量过高是河道水污染的主要原因之一.人造水草中的硝化细菌将污水中的含氮化合物最终转化为无污染物质,该过程涉及到的化学反应之一是:2NH3+3O2  2HNO2+2X.则X的化学式为 .
2HNO2+2X.则X的化学式为 .
尿素[CO(NH 2) 2]在工农业生产中应用广泛。
(1)尿素溶液能除去工业废气Cl 2.化学方程式为:CO(NH 2) 2+H 2O+3Cl 2=N 2+CO 2+6X,则X的化学式是 。
(2)尿素是目前使用量较大的一种 (选填"氮"、"磷"或"钾")肥,适用于各种植物,某水田施加7.2千克尿素,其中含氮元素多少千克?
有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末。工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通。小柯利用如图装置测定疏通剂中铝的质量分数。
Ⅰ.取样品20g,倒入容积为200mL的锥形瓶中,然后在分液漏斗中加入水,置于电子天平上测出总质量m 1。
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m 2。
Ⅲ.实验数据如下表:
| 反应前总质量m 1 |
反应后总质量m 2 |
| 371.84g |
371.24g |
回答下列问题:
(1)配平化学方程式:2Al+2NaOH+2H 2O  NaAlO 2+3H 2↑
NaAlO 2+3H 2↑
(2)根据化学方程式计算样品中铝的质量分数。
(3)以下情形会导致样品中铝的质量分数测量结果偏高的原因可能有 。
A.向锥形瓶中倒入样品时,撒出了部分粉末
B.在反应过程中有水蒸气逸出
C.没有等装置中氢气全部排尽就称量

质量守恒定律是自然界基本的规律之一。下列装置及实验(天平未画出)能用来验证质量守恒定律的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
浓硫酸具有脱水性,能把小木棍、蔗糖等中的氢元素和氧元素“脱出”结合生成水。
(1)用小木棍蘸取浓硫酸少许,一段时间后,小木棍上出现的实验现象是 。
(2)在蔗糖(C12H22O11)分子中,氢、氧原子个数比是 ,如果蔗糖完全脱水,则生成C和H2O的质量比是 。
碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究。
【猜想】Mg(OH)Cl分解后产物可能有:Mg、MgCl 2、MgO、HCl气体、H 2O、Cl 2。
【实验一】取少量的Mg(OH)Cl放入大试管中,按如图所示装置进行实验,加热过程中观察到足量硝酸银溶液中有白色沉淀产生,一段时间后,沉淀不再产生,大试管口也没有液滴形成,管内有固体剩余,无其他现象。由此推知Mg(OH)Cl分解后产物中有 气体,无其他气体。
【实验二】取少量实验一的剩余固体于试管中,加入足量稀盐酸,没有气泡产生,由此推知Mg(OH)Cl分解后产物中没有 。
【实验三】再取少量实验一的剩余固体,加入足量稀硝酸,固体全部溶解,再滴入AgNO 3溶液,无沉淀产生,由此推知Mg(OH)Cl分解后产物中没有 。
【结论】Mg(OH)Cl受热分解的化学反应方程式为 。

为了测定一瓶未密封保存的NaOH固体中NaOH的质量分数,小科采用沉淀法进行如下操作:①取15克样品于烧杯中,加足量水配成溶液;②在样品溶液中加入足量的BaCl2溶液;③待反应完全后,过滤。有关数据记录如表:
反应前 |
反应后 |
|
烧杯和样品溶液总质量/g |
加入的氯化钡溶液质量/g |
过滤后烧杯和溶液总质量/g(滤液的损失忽略不计) |
95 |
65 |
140.3 |
请回答下列问题:
(1)在反应前后的溶液中,下列元素质量保持不变的是
A.钠元素
B.碳元素
C.钡元素
D.氧元素
(2)反应共生成沉淀 克
(3)原样品中NaOH的质量分数是多少?
试题篮
()