下列各图象不能正确反映其对应变化关系的是( )
A. 电解水
电解水
B.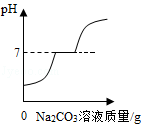 向氯化钙和盐酸的混合溶液中加入过量的碳酸钠溶液
向氯化钙和盐酸的混合溶液中加入过量的碳酸钠溶液
C. 向等质量的氧化锌和氢氧化锌中加入质量分数相同的稀盐酸至过量
向等质量的氧化锌和氢氧化锌中加入质量分数相同的稀盐酸至过量
D.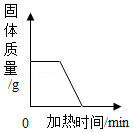 加热木炭和氧化铜的混合物
加热木炭和氧化铜的混合物
碳还原氧化铜的实验装置如图甲、乙所示。甲图中酒精灯上网罩的作用是 。
[提出问题]碳燃烧时可能生成CO 2也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?
[作出猜想]猜想Ⅰ:CO;猜想Ⅱ:CO 2;猜想Ⅲ: 。
[设计方案]实验装置如图乙所示。打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通入一段时间氮气。
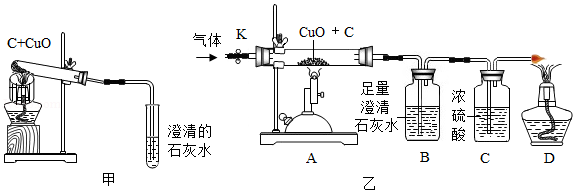
方案一:从定性观察角度判断
(1)实验时装置A处的现象是 。
(2)若B中无明显现象,D处的气体能点燃,则猜想 (填序号)成立。
方案二:从定量计算角度判断
取一定量碳粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
| |
反应前的质量 |
反应后的质量 |
| A(玻璃管+固体) |
m 1 |
m 2 |
| B+C(广口瓶+混合液) |
m 3 |
m 4 |
(3)若猜想Ⅱ成立,则理论上(m 4﹣m 3) (m 1﹣m 2)(填">""<"或"=")。
(4)若猜想Ⅲ成立且CuO全部转化成Cu,则参加反应的碳粉的质量m的取值范围是 [交流反思]实验开始前缓缓通入氮气的目的是 。
硫酸镁和硫酸的混合溶液中,硫元素的质量分数占4.8%.向100g该混合溶液中加入氢氧化钠溶液,恰好完全反应,测得消耗氢氧化钠溶液的质量为100g。下列说法不正确的是( )
| A. |
氢氧化钠溶液中溶质质量分数为12.0% |
| B. |
所得溶液中溶质质量为21.3g |
| C. |
生成氢氧化镁沉淀的质量为8.7g |
| D. |
氢氧化钠溶液中钠元素质量为6.9g |
下列图象分别对应四个变化过程,能正确反映对应变化关系的是( )
| A. |
|
| B. |
|
| C. |
|
| D. |
|
下列图象能正确表示对应关系的是( )
| A. |
|
| B. |
|
| C. |
|
| D. |
|
如图2为某钙片的商品标签,为测定钙片中钙元素的质量分数(假设钙片中其他物质不含钙元素,且不溶于水,也不与任何物质发生反应),某化学兴趣小组取20片钙片,进行如下实验:

(1)上述实验过程中发生反应的化学方程式为 。
(2)根据已知条件列出求解所加的稀盐酸中溶质质量(x)的比例式 。
(3)用36.5%的浓盐酸配制100g上述稀盐酸,所需浓盐酸的质量为 。
(4)钙片中钙元素的质量分数为 。
(5)若向滤液中加入5.4g水,所得溶液中溶质的质量分数为 。
(6)工厂生产钙片时若需碳酸钙120t,理论上需含氧化钙84%的生石灰的质量为 。
实验室欲测定一包黄铜样品中锌的质量分数(假设样品中只含铜和锌),取50g黄铜样品粉末于烧杯中,先加入100g稀硫酸,充分反应后得固液混合物149.8g,再继续加入200g相同浓度的稀硫酸,充分反应后过滤,得滤液312.6g,则黄铜样品中锌的质量分数为( )
| A. |
39% |
B. |
74% |
C. |
61% |
D. |
26% |
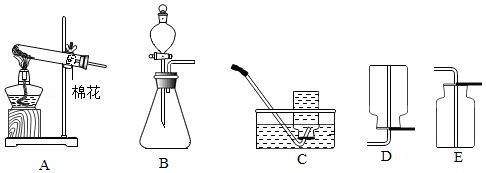
下列实验用品常用于实验室制取气体,回答下列问题:
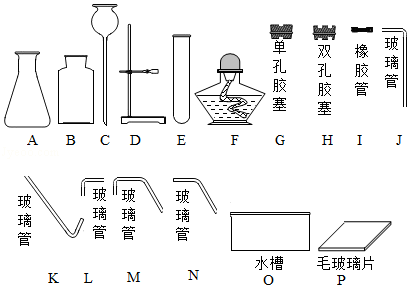
(1)仪器E的名称是 ;
(2)用2KMnO4 K2MnO4+MnO2+O2↑来制取O2,并用排水法收集,组装制取装置时,除选用图中的B、D、E、G、I、K、N、P外,还必须选用图中的 ;
(3)按上述反应加热31.6g的KMnO4完全反应后,理论上剩余固体质量为 g。
乙醇俗称酒精,可以用作酒精灯、内燃机等的燃料,用灯帽盖灭酒精灯的灭火原理是 ;乙醇完全燃烧的化学方程式为 ;现有乙醇和乙醛(CH3CHO)的混合物共13.4g,完全燃烧后生成26.4g CO2,则生成水的质量为 g。
已知镁和铝的相对原子质量之比为8:9,若镁和铝分别与足量盐酸反应,生成氢气的质量相等,则参加反应的镁和铝的质量比为( )
A.3:2B.4:3C.1:1D.1:2
向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。下列说法不正确的是( )

A.M点时,剩余固体是铜和氧化铜
B.M、N点时,溶液中的溶质均只有CuCl2
C.N、P点时,溶液的pH:N>P
D.混合物中铜的质量为(a﹣b)g
氧气是人类无法离开的物质。
(1)工业上常采用分离液态空气的方法获取O2.能说明空气中存在氧气的事例有 (写一点即可)。
(2)实验室用双氧水和二氧化锰制取并收集氧气,可选择的装置组合是 。
(3)高锰酸钾制取O2时,常用 (填仪器名称)提供热源;现制取3瓶氧气,集气瓶容积为250mL,需要高锰酸钾的质量至少为 g(通常氧气的密度约为1.34g/L,结果精确到0.1g)。
(4)某些空气净化剂含超氧化钾,其净化原理为:4KO2+2CO2═2K2CO3+3O2.该方法一般不用于实验室制取氧气的原因是 (写一点即可)。
用一氧化碳还原氧化铁的实验中,Fe2O3转化为铁的具体过程是:Fe2O3 Fe3O4 FeO Fe,已知铁的氧化物除Fe2O3外,其余均为黑色。下列说法正确的是( )

A.装置中漏斗的作用是防止倒吸
B.通过实验现象可以判断氧化铁是否完全转化为铁
C.该实验中所有的化学反应里,氧元素的化合价均未改变
D.当硬质玻璃管内固体中铁元素的质量分数为74%时,固体成分是Fe3O4和FeO
下列叙述错误的是( )
A.硫在氧气中燃烧发出蓝紫色火焰,生成二氧化硫气体
B.实验室丢失标签的KCl、NaOH、CuSO4三瓶溶液,不用加其他试剂就可相互鉴别
C.不慎将浓硫酸沾到皮肤上,立即用大量水冲洗,再涂上3%﹣5%的碳酸氢钠溶液
D.密闭容器中,3.4g H2O2完全分解,生成物的质量分别是:2.0g H2O,1.4g O2
试题篮
()